Automatisierte Produktionstechnologien für mRNA-basierte Arzneimittel

Bedarf und Herausforderung
Auf mRNA basierende Impfstoffe sowie Gen- und Zelltherapeutika sind innovative Arzneimittel mit welchen Infektionskrankheiten, Erbkrankheiten und Krebs verhindert oder behandelt werden können. Diese innovativen Arzneimittel verzeichneten in den vergangenen Jahren eine äußerst dynamische Entwicklung in der klinischen Forschung, Translation und Anwendung. Die Entwicklung von benötigten Produktionstechnologien hat mit dem rasanten biomedizinischen Fortschritt in diesen Bereichen jedoch noch nicht Schritt gehalten. Daher werden automatisierte und digital unterstützte Produktionstechnologien benötigt, um innovative mRNA-Arzneimittel schnell, sicher und zuverlässig zu entwickeln und nach den hohen Anforderungen der guten Herstellungspraxis (Good manufacturing practice GMP) zu produzieren. Übergeordnetes Ziel des Leitprojektes RNAuto ist es, automatisierte Herstellungsprozesse innovativer mRNA-Wirkstoffe für eine nachhaltige und wirtschaftliche Gesundheitsversorgung zu entwickeln.
Biologischer Hintergrund
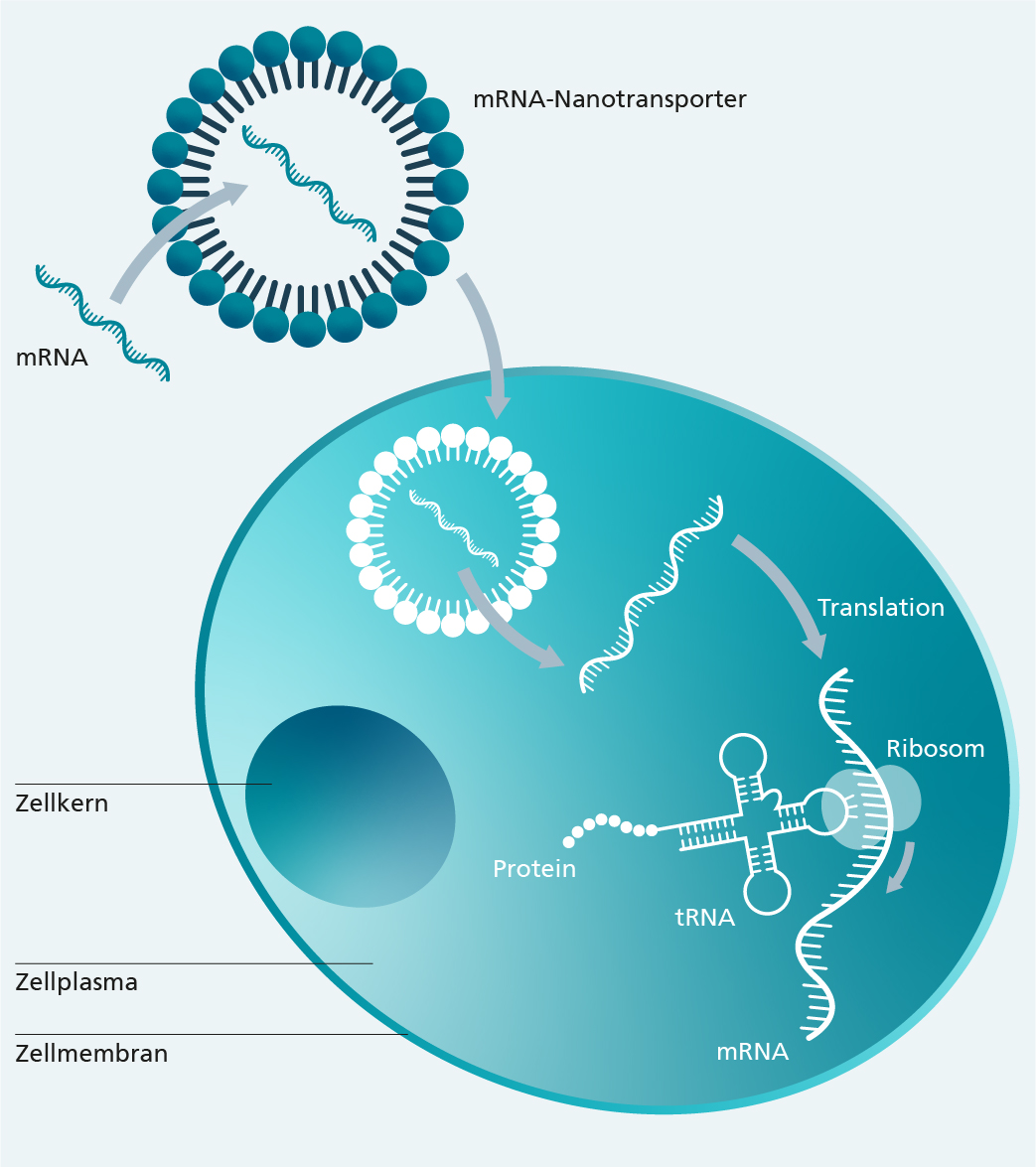
mRNA-Arzneimittel nutzen ein Wirkkonzept, welches sich seit drei Jahrzehnten in der Entwicklung befindet, erstmals aber durch die SARS-CoV-2-Impfstoffe breite Bekanntheit erlangte. mRNA (messenger RNA, dt. Boten-RNA)-Moleküle finden sich in allen Zellen. Ihre Aufgabe ist die Übertragung einer genetischen Information, dem Bauplan eines Proteins, von der DNA aus dem Inneren des Zellkerns zu den Ribosomen ins Zellplasma, wo die Information in ein funktionales Protein translatiert wird.
Bei mRNA-Arzneimitteln kodiert die Information in Form der mRNA den Wirkstoff. Das von der Zelle auf Basis der mRNA produzierte Protein vermittelt dann die Funktion, z. B. als prophylaktischer Impfstoff oder therapeutisches Protein. Überall dort also, wo Proteine eine relevante Rolle für Prophylaxe oder Therapie spielen, können zukünftig alternativ auch mRNA-Arzneimittel eingesetzt werden. Neben der Prophylaxe von Infektionskrankheiten und der Krebstherapie mit chimären Antigenrezeptor (CAR) modifizierten-Immunzellen kann dies z. B. auch bei monokausalen Erbkrankheiten zum Tragen kommen.
Vorteile bringt die mRNA-Technologie für die Patient*innen-Sicherheit und die Produktion mit sich, denn die Herstellung von mRNA ist weniger aufwendig als bei herkömmlichen Impfstoffen. Im Bereich der Gen- und Zelltherapie ist es von Vorteil, dass mRNAs nicht in das Genom von Patient*innenzellen integrieren. Eine entscheidende Herausforderung der mRNA-Technologie ist, dass für den Transfer von mRNA-Molekülen in Zellen Transfektionssysteme eingesetzt werden, mit welchen die mRNA stabilisiert und effizient in Zellen eingeschleust werden kann. Biokompatible Nanotransporter aus Lipiden können die mRNA in nanoskopische Transportvehikel verpacken (verkapseln) und den Transfer in Zellen ermöglichen.
Technischer Hintergrund
Die Verkapselung der mRNA in Nano-Transportkapseln aus Lipiden erfolgt durch die Mischung gelöster Lipide mit mRNA, anschließender Umpufferung und Aufkonzentrierung sowie Fraktionierung. Die Qualitätskontrolle der verkapselten mRNA mittels dynamischer Lichtstreuung (DLS) ist auf die Ermittlung der Partikelgröße und deren Verteilung limitiert. Zur Herstellung eines zuverlässigen mRNA‑Arzneimittels muss eine gleichbleibende Produktqualität gewährleistet werden, die auch die Quantifizierung der Menge verkapselter mRNA in den Nanotransportern einbezieht. Das ungleichmäßige Verhältnis verkapselter mRNA im Anlauf des Mischprozesses und hohe Durchflussraten im Produktionsprozess stellen Herausforderungen für eine fortlaufende Qualitätskontrolle dar. Wegen resultierender Schwankungen in den Viskositäten der Mischung, Brechungsindizes, Leitfähigkeiten, Temperaturen sowie pH-Werten und dem entsprechenden Einfluss auf die Produktqualität ist nicht nur eine Prozessoptimierung, sondern auch die umfassende Qualitätskontrolle der Fraktionen im Projekt thematisiert. Des Weiteren wird im Rahmen des Projektes die kontinuierliche Produktion von Immunabwehrzellen in einem neuartigen Bioreaktor etabliert.
Die bisherigen Produktionstechnologien für die skalierte, qualitätsgesicherte und GMP-konforme Herstellung von Zelltherapeutika sind für die avisierten Anwendungen unzureichend. Halbautomatische All-in-One-Geräte für die Herstellung von Gen- und Zelltherapeutika haben einige Nachteile hinsichtlich Prozessanpassung und Flexibilität. Lösungen für Inline-Qualitätskontrollen für funktionale Zellmerkmale fehlen. So ist der Anteil manueller Prozesse, die durch qualifiziertes Personal durchgeführt werden müssen, nach wie vor sehr hoch. Zudem sind die Geräte nicht für allogene Off-the-shelf-Zelltherapeutika nutzbar.
Ein Ziel des Projektes ist es, Herstellungsprozesse zu entwickeln und zu etablieren, die vom klinischen bis zum industriellen Maßstab skalieren. Dazu wird ein geschlossenes Expansionsmodul mit einer dynamischen Anpassung des Kulturvolumens bei zunehmender Zellzahl entwickelt. Die Zellen werden darin, besonders schonend, in einer Sedimentationskultur auf einer Doppelmembran kultiviert.
Für eine optimale Integrationsfähigkeit werden Funktionsmodule mit kleinem Bauraum bei ausreichend großer Kulturfläche realisiert. So können allogene Zellprodukte für 50 bis 100 Patient*innen innerhalb eines Batches hergestellt und Systeme einfach parallelisiert werden. In der Folge wird das Verfahren effizienter, schneller und günstiger.
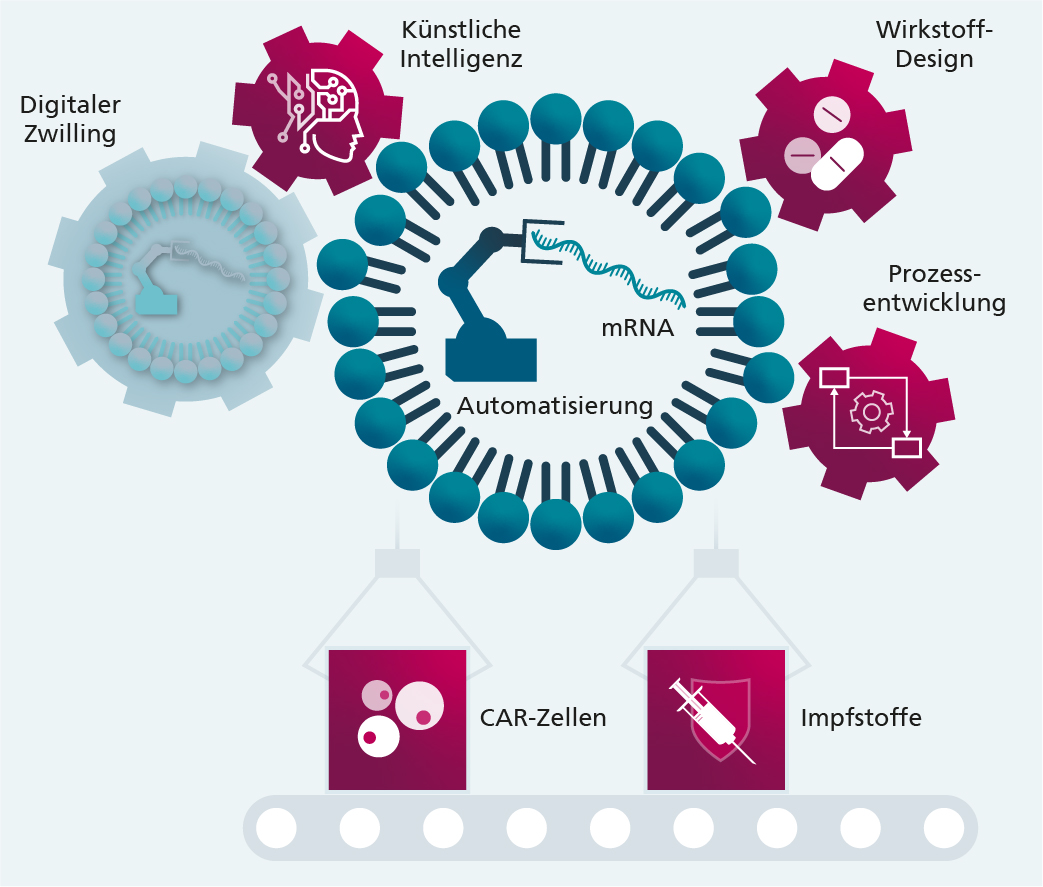
Um eine automatisierte Herstellung von mRNA-basierten Wirkstoffen zu erreichen, werden technische Lösungen in den Bereichen Bioreaktoren, Fluiddynamik, Qualitätskontrolle und automatisierte Datenanalyse etabliert. Zentrale Elemente des Konzepts Industrie 4.0 werden genutzt, um die Produktionsprozesse digital abzubilden und zu überwachen.
Abgesehen von der Steuerung der einzelnen Geräte ist bei der Advanced Therapy Medicinal Products (ATMP)-Produktion auch die Sicherstellung der Datenintegrität von hoher Relevanz. Aufgrund der hohen Komplexität der einzelnen Prozessschritte werden die benötigten und entstehenden Daten nur inkonsistent erfasst und können anschließend nicht oder lediglich manuell für den weiteren Gebrauch herangezogen werden. Diese Limitierung lässt sich jedoch mit dem Konzept des digitalen Zwillings überwinden, bei dem die relevanten Daten und Simulationen über den gesamten Lebenszyklus eines ATMPs aufgenommen und gespeichert werden. Dadurch können auch alle für die Produktion benötigten Informationen eingesetzt werden. Die Einbindung des digitalen Zwillings kann in mehreren Stufen erfolgen. In der ersten Stufe werden alle Produktdaten über den Lebenszyklus eines ATMPs hinweg gemeinsam erfasst. Dies ermöglicht eine konsistente Dokumentation und Nachvollziehbarkeit, mit deren Hilfe eine vereinfachte Wiederholbarkeit auch in anderen Produktionsumgebungen ermöglicht wird. Werden zusätzlich Daten über die Produktion und eingesetzte Ressourcen erhoben und im digitalen Zwilling integriert, können die einzelnen Produktionsschritte einfacher aufeinander abgestimmt werden. Darauf aufbauend werden in der nächsten Stufe prozessschrittübergreifende Prozesskontrollen ermöglicht. Dieser Ansatz kann wiederum bei der Absicherung der Prozessqualität und der vollständigen Automatisierung der Produktion unterstützen, auch der Einsatz von künstlicher Intelligenz zur weiteren Optimierung ist dabei denkbar.
Entwicklungsziele
Im Fokus des Leitprojekts stehen die Entwicklung von Bioprozessverfahren und Produktionstechnologien für die modulare, automatisierte und bis zum Industriemaßstab skalierbare Herstellung von mRNAs, mRNA-Nanotransportern und mRNA-modifizierten Zellen. Um eine automatisierte Herstellung von mRNA-basierten Wirkstoffen zu erreichen, werden technische Lösungen in den Bereichen Bioreaktoren, Fluiddynamik, Qualitätskontrolle und automatisierte Datenanalyse etabliert. Zentrale Elemente des Konzepts Industrie 4.0 werden genutzt, um die Produktionsprozesse digital abzubilden und zu überwachen. Das Leitprojekt etabliert und wendet praktische Wirkstoffkandidaten für die Entwicklung der neuen Prozess- und Produktionstechnologien an: die Herstellung mRNA-basierter Impfstoffe und die Herstellung mRNA-induzierter Gen- und Zelltherapeutika.
Konkrete Projektziele
- Automatisierbares Verfahren für die Verpackung von mRNA in Nanotransporter
- Entwicklung einer Screening-Anlage für die automatisierte mRNA-Verkapselung mit integrierter Online-Analytik zur Qualitätssicherung und Dokumentation für die beschleunigte Bioprozessentwicklung
- Expansionsmodul mit integrierter Qualitätskontrolle für die Herstellung allogener Gen- und Zelltherapeutika
- mRNA-Wirkstoffkandidaten: Impfstoff gegen das West-Nil Virus, Gen- und Zelltherapeutika gegen hämatologische Krebserkrankungen
Beteiligte Fraunhofer-Einrichtungen
- Fraunhofer-Institut für Toxikologie und Experimentelle Medizin ITEM (item.fraunhofer.de)
- Fraunhofer-Institut für Mikrotechnik und Mikrosysteme IMM (imm.fraunhofer.de)
- Fraunhofer-Institut für Produktionstechnik und Automatisierung IPA (ipa.fraunhofer.de)
- Fraunhofer-Institut für Produktionstechnologie IPT (ipt.fraunhofer.de)
- Fraunhofer-Institut für Experimentelles Software Engineering IESE (iese.fraunhofer.de)
- Fraunhofer-Institut für Mikroelektronische Schaltungen und Systeme IMS (ims.fraunhofer.de)
- Fraunhofer-Institut für Zelltherapie und Immunologie IZI (izi.fraunhofer.de)
- Fraunhofer-Institut für Zelltherapie und Immunologie, Institutsteil Bioanalytik und Bioprozesse IZI-BB (izi-bb.fraunhofer.de)