Präklinische Testung eines ATMP zur Behandlung von Knieknorpelschäden abgeschlossen
Das Fraunhofer-Institut für Zelltherapie und Immunologie IZI ist als GLP-Prüfeinrichtung zertifiziert. Zuletzt wurde am Institut u.a. eine präklinische Studie zur Testung der Unbedenklichkeit eines ATMP zur Behandlung von Knorpelschäden am Knie durchgeführt. Ein von der BioPlanta GmbH entwickeltes Arzneimittel für neuartige Therapien (Advanced Therapy Medicinal Product, ATMP) wurde dafür umfangreichen Prüfungen unter GLP-Bedingungen hinsichtlich seiner potenziellen unerwünschten Biodistribution und Tumorigenität unterzogen.

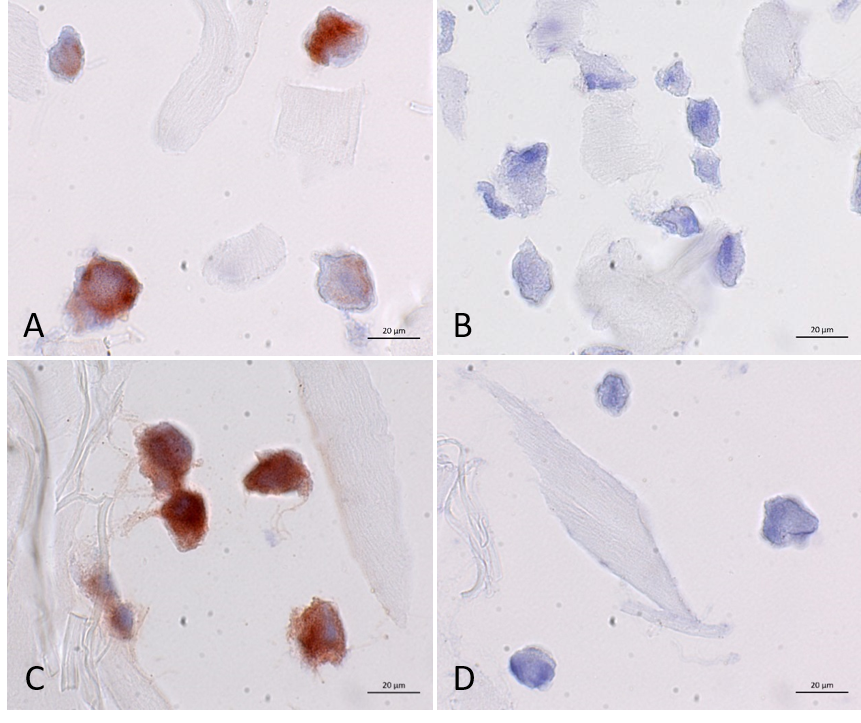
Unsere Kniegelenke sind von einer etwa fünf Millimeter dicken Knorpelschicht bedeckt. Durch die gleichmäßige Verteilung von Druck- und Stoßbelastung schützt sie unsere Gelenke, ihre glatte Oberfläche ermöglicht eine reibungslose Bewegung. Allerdings nutzt sich diese Knorpelschicht im Laufe des Lebens ab und kann sich nicht selbst regenerieren. Neben einer akuten Verletzung durch einen Unfall kann insbesondere eine chronische Fehlbelastung die Kniegelenkknorpel dauerhaft schädigen. Dies ist für Betroffene sehr schmerzhaft und kann zu erheblichen körperlichen Einschränkungen führen. Unbehandelt kann sich aus einem Knorpelschaden eine Kniegelenksarthrose entwickeln.
Mittels Physiotherapie kann ein Knorpelschaden nicht geheilt, sondern nur gelindert werden. Als Alternative zur Implantation einer Teil- oder Vollprothese des Kniegelenks steht aktuell die autologe Knorpeltherapie zur Verfügung. Hierbei werden körpereigene Knorpelzellen aus dem Kniegelenk entnommen, im Labor unter GMP-Bedingungen vermehrt und dem Patienten danach transplantiert, um den fokalen Knorpelschaden unter weitgehender Wiederherstellung der Funktionalität zu heilen. Die BioPlanta GmbH verfolgt einen neuen Ansatz, der standardisierbar und weniger aufwändig ist. Genutzt werden dafür Stammzellen aus Nabelschnurgewebe, da diese besonders anpassungsfähig auch an fremde Immunsysteme sind. In das geschädigte Knie implantiert, soll damit das Wachstum neuen Knorpelgewebes angeregt werden. Bis es soweit ist und ein solches neues ATMP zugelassen wird, müssen zunächst aber diverse präklinische und klinische Prüfungen durchlaufen und bestanden werden.
Am Fraunhofer IZI wurden jetzt die präklinischen Prüfungen unter GLP-Bedingungen für dieses ATMP abgeschlossen. Studienleiter Dr. Jörg Lehmann, Leiter der Abteilung Präklinische Entwicklung und Validierung, erläutert: »Die im Rahmen der präklinischen GLP-Studie erhobenen Daten zur Beurteilung der Unbedenklichkeit sind ein wesentlicher Bestandteil für den Zulassungsantrag für das ATMP und eine essentielle Voraussetzung für die nachfolgenden klinischen Prüfungen des Zelltherapeutikums.« Das Fraunhofer IZI verfügt über eine langjährige Expertise – seit 2009 ist es als GLP-Prüfeinrichtung für derartige Prüfstudien zertifiziert – und ermöglicht die Planung und Durchführung von präklinischen Wirksamkeits- und Sicherheitsprüfstudien für neue Arzneimittelkandidaten (insbesondere ATMPs) und Medizinprodukte (gemäß ISO 10993) unter GLP-Bedingungen.