Außenstelle Zelluläre Immuntherapie
Die Außenstelle Zelluläre Immuntherapie unterstützt die Entwicklung, Herstellung und Anwendung von CAR-Immunzellen mit umfassender Expertise. Das Team setzt die genetische Modifikation von T-Zellen, NK-Zellen und Makrophagen mittels viraler und nicht-viraler Gentransferverfahren sowie deren funktionelle und phänotypische Charakterisierung um.
Je nach Bedarf stehen Kunden und Partnern folgende Leistungen flexibel zur Verfügung:
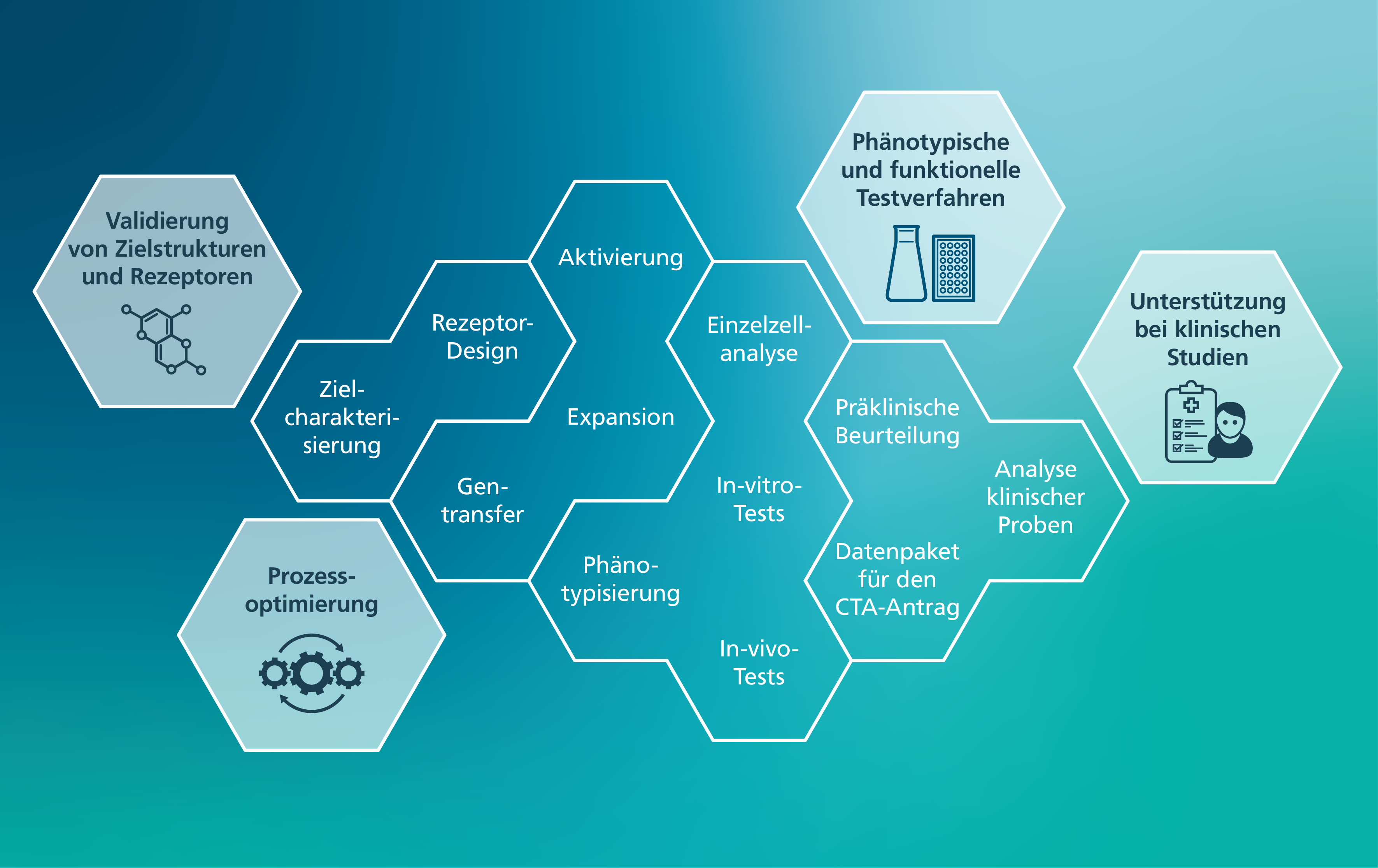
Validierung von Zielstrukturen und Rezeptoren
Das Team unterstützt Sie bei der Bekämpfung von Krebs und nicht-malignen Erkrankungen durch die Entwicklung optimierter chimärer Antigenrezeptoren (CARs), die individuell auf Ihre Anforderungen zugeschnitten sind. Mit umfassender Erfahrung und proprietären CAR-Technologien begleitet die Gruppe die Zielvalidierung und das CAR-Design, um Rezeptoren zu schaffen, die eine präzise und wirkungsvolle Zielerkennung gewährleisten.
Das Leistungsspektrum umfasst unter anderem:
- Charakterisierung der Zielproteine auf malignen Zellen
- Optimierung von CAR-Konstrukten mittels proprietärer Technologien
Prozessoptimierung
Der Übergang von Reagenzien aus der Entwicklungsphase zur wissenschaftlichen Anwendung wird durch Prozessoptimierung in der Immunzellherstellung unterstützt. Durch die Nutzung der Expertise des Teams in der Protokolloptimierung werden Reagenzien und Techniken anhand modernster Herstellungsstandards für die Immuntherapie bewertet und verglichen.
Dies kann Folgendes umfassen:
- Aktivierungsreagenzien
- Gen-Transfer-Techniken, einschließlich Verpackungssystemen (zum Beispiel LNPs / PNPs, virale Systeme) sowie Integrationswerkzeugen (Transposasen, zum Beispiel Sleeping Beauty)
- Zellpenetrierende Methoden wie Elektroporation, Mechanoporation oder Squeezing
- Neue Medienformulierungen
- Neue Kultivierungsgeräte (Bioreaktoren, Kultiviergefäße)
- Zytokine zur Supplementierung während der Zellkultur
Phänotypische und funktionelle Testverfahren
Die Entwicklung von CAR-Konstrukten wird durch umfassende phänotypische und funktionelle Analysen unterstützt, um Wirksamkeit und Spezifität zu bewerten. Validierte Protokolle, standardisierte Arbeitsanweisungen (SOPs) und etablierte Modelle gewährleisten hochwertige und verlässliche Ergebnisse. Zum Leistungsumfang gehört die detaillierte phänotypische Charakterisierung von Immunzellen auf Proteinebene, um deren Eigenschaften besser zu verstehen und gezielt zu optimieren. Darüber hinaus werden umfassende funktionelle Analysen der Effektormechanismen von CAR- und Immunzellen durchgeführt: Von der Bewertung fertiger Zellprodukte bis hin zur Multi-Assay-Profilierung einzelner Immunzellen. Dies ist entscheidend für die Bewertung des therapeutischen Potenzials und die Sicherheit von CAR-basierten Immunzellprodukten.
Dies kann Folgendes umfassen:
- Multiparametrische phänotypische Charakterisierung von Immunzellen (Aktivierung, Differenzierung, Erschöpfung) mittels Durchflusszytometrie
- Tumorzelllyse primärer Tumore und Zelllinien (Luciferin-Assay, Durchflusszytometrie, Incucyte)
- Analyse der Zytokinsekretion (Einzelzytokine oder Multiplex-Panels)
- Proliferationsassays
- RNA-Profiling (String-Technologie)
- Einzelzellanalysen mit der Beacon Select Plattform (Bruker)
Unterstützung bei klinischen Studien
Das Team bringt Expertise aus prüferinitiierten ATMP-Studien ein und unterstützt Sie bei Einrichtung, Durchführung und Validierung klinischer Studien – fachkundige Unterstützung steht Ihnen in jeder Phase des Prozesses zur Verfügung.
Dies kann Folgendes umfassen:
- Erstellung eines präklinischen Datenpakets (in vitro) zur Unterstützung von klinischen Prüfungsanträgen (zum Beispiel für die Investigator’s Brochure)
- Analyse klinischer Proben, einschließlich:
- Nachweis von ATMPs im Blut mittels Durchflusszytometrie
- Quantifizierung von Serumzytokinen
Weitere Dienstleistungen
Gerätevalidierung
Die Außenstelle Zelluläre Immuntherapie bietet Biotech- und Pharmaunternehmen sowie Partnern aus den Life Sciences die Möglichkeit, Geräte, die in der Entwicklung zellulärer Immuntherapien eingesetzt werden, umfassend zu testen und zu validieren. Standardisierte, klinisch validierte Herstellungsprotokolle dienen als Referenz, um die Leistungsfähigkeit und Zuverlässigkeit neuer Technologien objektiv zu bewerten. Validierte Standards gewährleisten höchste Qualitäts- und Sicherheitsanforderungen – eine essenzielle Grundlage für die erfolgreiche Entwicklung innovativer Immuntherapien.
Testung und Optimierung von Reagenzien für die Immunzellherstellung
Neue Reagenzien und Techniken zur Herstellung von CAR-Immunzellen werden anhand standardisierter Protokolle aus der klinischen Immuntherapie bewertet. Gemeinsam wird eine Applikationsbeschreibung (Application Note) erstellt, die die Vermarktung Ihrer Produkte unterstützt.
Dies kann folgende Leistungen umfassen:
- Vergleichende Tests von Aktivierungs- und Kulturreagenzien (zum Beispiel Zytokine, Medien, Stimulatoren)
- Unterstützung bei der Entwicklung und Implementierung alternativer Zellkultursysteme zur Steigerung der Prozesseffizienz und Nachhaltigkeit