Antikörpertechnologien
Ressourceneffiziente Antikörperproduktion
Die Außenstelle Molekulare Wirkstoffbiochemie und Therapieentwicklung entwickelt spezielle Antikörper, die gezielt an veränderte Formen amyloider Proteine binden. Diese Antikörper besitzen großes Potenzial für den zukünftigen Einsatz in Diagnostik und Therapie amyloidbedingter Erkrankungen, da sie krankheitsassoziierte Proteinformen von ihren physiologisch funktionsfähigen Varianten unterscheiden.
Dieses selektive Bindungsverhalten ist entscheidend, da amyloide Proteine – wie etwa Transthyretin (TTR) oder β-Amyloid (Aβ) – im Krankheitsfall sowohl in pathologisch veränderter Form als auch in natürlicher, funktioneller Form im Körper vorkommen. Bei der ATTR-Amyloidose beispielsweise können die Antikörper helfen, die in Herz und Nerven pathologisch abgelagerten TTR-Fibrillen spezifisch zu identifizieren, ohne dass das zirkulierende, physiologisch aktive TTR den Nachweis beeinträchtigt. In der Alzheimer-Forschung wiederum könnten sie im Rahmen einer passiven Immuntherapie gezielt die schädlichen Aβ-Ablagerungen im Gehirn binden, ohne die physiologische Form des Proteins zu beeinflussen.
Um diesen innovativen Ansatz weiter zu verfolgen und präklinische Studien durchführen zu können, sind größere Mengen dieser Antikörper erforderlich (0,5-10 g/Liter). Die bisherige Herstellung ist jedoch zeit- und kostenintensiv und führt nur zu geringen Produktionsmengen (0,001-0,03 g/Liter).
Ziel des Projektes ist es deshalb, eine hochproduktive Master-Zelllinie zu entwickeln, mit der sich die benötigten Antikörpermengen effizient herstellen lassen. In diese Zelllinie kann dann durch den einfachen Prozess der Rekombination jederzeit schnell und kostengünstig ein neues Zielprotein integriert werden. Die Master-Zelllinie soll künftig sowohl für die kosteneffektive Produktion neuer Protein-Therapeutika als auch im Rahmen anwendungsorientierter Grundlagenforschung eingesetzt werden.
Das Verbundprojekt »OptimumAntibody: Ressourceneffiziente Antikörperproduktion« wird in Kooperation mit der Hochschule Anhalt durchgeführt und vom Europäischen Fonds für regionale Entwicklung (EFRE) sowie dem Land Sachsen-Anhalt gefördert.
Projektleitung: Mathias Schenk

Charakterisierung von HERV-Hüllproteinen mit dem Ziel der Entwicklung therapeutischer Antikörper für HERV-assoziierte Autoimmun- und Tumorerkrankungen
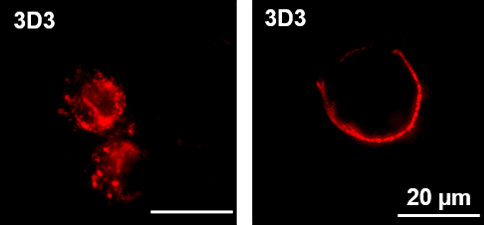
Humane endogene Retroviren (HERV), und hier insbesondere deren Hüllproteine, stehen im Verdacht Krankheiten wie Multiple Sklerose, Rheuma oder Tumorerkrankungen zu befördern. Noch ist nicht geklärt, welche Funktion diese Faktoren im Einzelnen haben. Es werden Zellschädigungen und die fehlgeleitete Stimulation des Immunsystems durch HERV als Krankheitsmechanismus angenommen. Neue Erkenntnisse sollen helfen, das Verständnis über die Rolle von HERVs bei der Entstehung von Autoimmun- und Krebserkrankungen zu verbessern.
In einem gemeinsamen Forschungsprojekt mit der Universitätsmedizin Halle gelang es Forschenden am Fraunhofer IZI, HERV-Hüllproteine biotechnologisch herzustellen und deren biologische Aktivität zu charakterisieren. Diese Proteine dienten zugleich als Antigene für die Generierung von poly- und monoklonalen Antikörpern. Weiterhin konnten die biologischen Effekte von HERV-Hüllproteinen in Zellkulturen und Versuchstieren untersucht und deren immunstimulatorischen Eigenschaften charakterisiert werden. Gemeinsam mit den Projektpartnern von der Universitätsmedizin Halle gelang außerdem die Identifizierung von HERV-Sequenzen in verschiedenen Tumorentitäten.
Damit bereitet das Forschungsvorhaben den Weg für neue Therapieverfahren, die der Behandlung von Autoimmun- und Tumorerkrankungen dienen.
Das Projekt »Charakterisierung von HERV-Hüllproteinen mit dem Ziel der Entwicklung therapeutischer Antikörper für HERV-assoziierte Autoimmun- und Tumorerkrankungen« wurde vom Europäischen Fonds für Regionale Entwicklung (EFRE) und dem Land Sachsen-Anhalt gefördert. Die Förderung erfolgte im Rahmen des Programms »Sachsen-Anhalt WISSENSCHAFT – SCHWERPUNKTE«, mit dem das Land Sachsen-Anhalt Forschungsschwerpunkte und innovative Forschungsvorhaben im Wissenschaftsbereich unterstützt.
Publikationen

Weitere Projekte
- DFG: »Identifizierung von Abeta-Peptid-Mustern im Gehirn von Alzheimer-Patienten mit neuen monoklonalen Antikörpern« (2226/17-1ï SCHI 1437/4-1)
Antragsteller: Prof. Dr. Steffen Roßner, Leipzig und Dr. Stephan Schilling, Halle/S. - DFG: »Enzymatische Regulation der Bioaktivität von CCL2 bei neuroinflammatorischen Prozessen« (RO 2226/15-1ï SCHI 1437/2-1)
Antragsteller: Prof. Dr. Steffen Roßner, Leipzig und Dr. Stephan Schilling, Halle/S.