Contact Press / Media
Dr. Anna Dünkel
Arbeitsgruppenleitung GMP Prozessentwicklung
Fraunhofer-Institut für Zelltherapie und Immunologie
Perlickstraße 1
04103 Leipzig
Telefon +49 341 35536-3612


Ziel des Projektes ist die Entwicklung einer integrierten und automatisierten Herstellungsplattform, zur dezentralen Herstellung von CAR-T-Zelltherapeutika. Das System, welche in Krankenhäusern und medizinischen Zentren platziert werden kann, soll perspektivisch sowohl die Produktionszeiten, wie auch die Kosten zur Herstellung zellbasierter Immuntherapeutika signifikant senken und damit den Zugang zu diesen lebenswichtigen Medikamenten erweitern.
Hierfür arbeitet ein von der EU gefördertes Konsortium, bestehend aus 18 industriellen und akademischen Partnern, unter der Koordination von Fresenius zusammen. Basis für das Projekt, ist eine von Fresenius Kabi entwickelte Technologie, welche im Rahmen des Vorhabens weiterentwickelt wird.
Das Fraunhofer IZI bringt hierbei seine Expertise in der Entwicklung und Herstellung von CAR-T-Zelltherapien und verschiedenen anderen zellbasierten Therapeutika ein und übernimmt verschiedene Aufgaben innerhalb des Konsortiums. Dazu gehören unter anderem die Testung und Optimierung der Point-of-Care Herstellungsplattform und entsprechender Verbrauchsmaterialien sowie deren Validierung gegenüber herkömmlichen Herstellungsverfahren im zentralisierten Labor. Weiterhin wirkt das Fraunhofer IZI an der Erarbeitung von Studien und Konzepten mit, in deren Mittelpunkt die Integration der Plattform in die Arbeitsabläufe von Kliniken und regulatorische Aspekte stehen.
Mit dem Fraunhofer IESE ist ein zweites Institut der Fraunhofer-Gesellschaft beteiligt, welche einen digitalen Zwilling der Technologie entwickelt, anhand dessen weitere Optimierungen erfolgen.
Förderung
Das Projekt wird durch die EU im Rahmen der Innovative Health Initiative Joint Undertaking (IHI JU) gefördert (grant agreement No 101194710).
Haftungsausschluss
Finanziert von der Europäischen Union, den privaten Mitgliedern und den beitragenden Partnern des Gemeinsamen Unternehmens IHI. Die geäußerten Ansichten und Meinungen sind jedoch ausschließlich die des Autors/der Autoren und spiegeln nicht notwendigerweise die der genannten Parteien wider. Keine der vorgenannten Parteien kann für sie verantwortlich gemacht werden.
Partner
Fresenius SE & Co. KGaA (Koordination) (DE), Helios Hospital Berlin-Buch (DE), QS Instituto (ES), Fenwal Inc. (US), Cellix Ltd. (IE), Charles River (DE), Pro-Liance Global Solutions (DE), TQ Therapeutics (DE), Philips Electronics Nederland B.V. (NL), Fraunhofer IESE (DE), Helmholtz-Zentrum Dresden-Rossendorf (DE), Technical University of Denmark (DK), Frankfurt School of Finance & Management (DE), European Society for Blood & Marrow Transplantation (SP), Bar-Ilan University (IL), University of Glasgow (UK), University of Navarra (ES).
Neuartige Zell- und Gentherapien, wie die CAR-T-Zelltherapie, erweitern kontinuierlich das Behandlungsspektrum in der Krebsmedizin. Insbesondere bei der Behandlung bestimmter hämatologischer Krebserkrankungen wurden in den vergangenen Jahren beeindruckende klinische Erfolge gezeigt. Dass das medizinische Potenzial auch über den Bereich der Krebsmedizin hinaus enorm ist, zeigen erste Behandlungserfolge bei einzelnen Patient*innen mit Autoimmunerkrankungen. Da sich die Auslöser von Autoimmunerkrankungen von denen onkologischer Krankheiten jedoch maßgeblich unterscheiden, besteht noch umfassendes Forschungs- und Entwicklungspotenzial. Bislang gibt es für diese Erkrankungen keine kurativen Behandlungsansätze.
Die meisten Autoimmunerkrankungen werden durch selbst-reaktive T-Zellen ausgelöst, welche fälschlicherweise gesunde, körpereigene Strukturen als »fremdartig« erkennen und daraufhin attackieren. Im Rahmen des DepleTe-Projekts werden Immunzellen durch modernes Genome-Engineering befähigt selbst-reaktive T-Zellen zu erkennen und zu zerstören. Das Projekt schafft damit die Grundlagen für innovative Zelltherapien, welche spezifisch die Auslöser von Autoimmunerkrankungen bekämpfen, ohne dabei die Funktionen des gesunden Immunsystems zu beeinträchtigen.
Im Auftrag der Universitätsmedizin Göttingen wird eine GMP-konforme Masterzellbank entwickelt und hergestellt, als Basis für einen pharmazeutischen Herstellungsprozess eines AAV-basierten Medikaments. Hierfür wird zunächst eine geeignete Zelllinie identifiziert und etabliert, die auf das spezifische Produkt des Auftraggebers abgestimmt ist. Nach erfolgreicher Expansion erfolgt eine umfassende Charakterisierung der Zellen zur Bestimmung von Identität, Reinheit, Vitalität und biologischer Aktivität. Parallel dazu wird eine umfassende Qualitätskontrolle implementiert.
Die Dokumentation aller Schritte und Ergebnisse wurde sorgfältig durchgeführt, um die Nachvollziehbarkeit des Prozesses zu gewährleisten. Schließlich erfolgte die Freigabe der Masterzellbank durch das Qualitätssicherungsteam, was die GMP-Konformität bestätigte. Dieser strukturierte Ansatz gewährleistet, dass die Masterzellbank den höchsten Qualitäts- und Sicherheitsstandards entspricht.
Die derzeitigen Protokolle für die autologe Ex-vivo-Gen- und Zelltherapie umfassen eine arbeits-, zeit- und kostenintensive Versorgungskette. Dabei werden die Zellen der Patient*innen in der Regel in einem spezialisierten klinischen Zentrum entnommen und zunächst an eine zentrale Herstellungsstätte geliefert. Dort werden die Zellen genetisch modifiziert, expandiert und umfassenden Qualitätskontrollen unterzogen. Das kryokonservierte Zellprodukt wird anschließend wieder an das Krankenhaus zurückgeschickt und die Therapie durchgeführt. Um den zukünftig wachsenden Bedarf decken zu können und einen breiten Zugang zu Zell- und Gentherapien zu ermöglichen, werden derzeit Herstellungsprotokolle entwickelt, die Produktionszeit und -kosten signifikant reduzieren.
Die derzeitigen Methoden für die gentechnische Herstellung therapeutischer Zellprodukte weisen verschiedene Limitierungen auf. Dazu gehören die fehlende langfristige Expression von Transgenen, das Risiko der Insertions-Onkogenese und anderer schädlicher Mutationen des Genoms der Empfängerzellen. Zudem ist die Herstellung genetischer Vektoren in pharmazeutischer Qualität mit erheblichen Kosten verbunden.
Nichtvirale Gentransfer-Technologien sind eine vielversprechende Option, um die Herstellung gentechnisch veränderter Zellen deutlich kostengünstiger zu gestalten.
Die einfachsten, aus der Natur bekannten, Gentransfervehikel sind Transposons. Die Genomintegration durch Transposase-Enzyme macht Transposons zu einzigartigen nichtviralen Vektorsystemen, die als Werkzeuge für vielseitige Anwendungen in der Gentechnik, einschließlich der Gentherapie, eingesetzt werden können. Eines der am besten charakterisierten Transposons, das Sleeping-Beauty-Transposon, verfügt über ein großes Potenzial, sichere und wirtschaftlich tragfähige Zelltherapeutika zu entwickeln. Bislang jedoch stellen die suboptimale Effizienz der genomischen Integration in bestimmten menschlichen Zelltypen, die unzureichend kontrollierte Transposase-Expression in genveränderten Zellen und das Risiko der Insertionsmutagenese durch zufällige genomweite Integration, noch relevante Einschränkungen der Technologie dar.
Im Rahmen des Projekts sollen Wirksamkeit und Sicherheit der Sleeping-Beauty-Transposon-Technologie verbessert und diese für die klinische Entwicklung vorbereitet werden.
Chimäre Antigenrezeptor (CAR)-Zelltherapeutika gelten als bahnbrechende Innovation in der Krebstherapie. Sie sind bisher ausschließlich für wenige hämatologische Krebsarten zugelassen. Zahlreiche präklinische und zunehmend auch klinische Studien belegen ein enormes Potenzial der Technologie in weiteren onkologischen Indikationen und darüber hinaus.
Aktuell erfolgt die Herstellung von zugelassenen CAR-Zelltherapeutika durch eine stabile gentechnische Veränderung von Immunzellen mittels viraler Transduktion. Die virale Generierung von CAR-Immunzellen ist allerdings ein sehr zeit-, material- und kostenaufwendiges Verfahren und daher für die breite Testung neuer CAR-Konstrukte mittels Screening-Verfahren ungeeignet.
Am Fraunhofer IZI wurde deshalb ein auf mRNA-Transfektion basierendes, zeit- und kostensparendes Verfahren zur effizienten Generierung von neuen CAR-Immunzellen entwickelt. Dieses Verfahren erlaubt es, im Hochdurchsatz-Screening zügig optimale Kandidaten für neue CAR-Zelltherapeutika zu identifizieren und funktionell auf Anti-Tumor-Effektivität zu testen. Auf diese Weise wird die präklinische Entwicklung wesentlich beschleunigt.
Das mittlerweile patentierte Verfahren steht nun Partnern aus akademischer und industrieller Forschung zur Verfügung und kann auf andere Tumorarten oder weitere Krankheitsbilder, zum Beispiel Autoimmunerkrankungen oder Fibrose, schnell und kostengünstig adaptiert werden.
Ziel des Projekts ist die Bereitstellung einer Technologieplattform, mit der die präklinische Entwicklung von CAR-modifizierten Immunzelltherapien beschleunigt wird. Dabei werden insbesondere schwer behandelbare Krebsarten und solide Tumore adressiert.
Mittels gezielter Kombination von CAR-Modifikationen und Gen-Editierungen sollen die antitumorale Aktivität, Tumorinfiltration und Langlebigkeit von T- und NK-Zellen verbessert und immunsuppressive Faktoren in der Tumorumgebung überwunden werden. Dem Konsortium steht dabei ein breites Portfolio an bereits identifizierten Zielmolekülen zur Generierung von CAR-Immunzellprodukten zur Verfügung, die im Rahmen des Projekts weiterentwickelt und validiert werden.
Das Fraunhofer IZI bringt seine Expertise in der Entwicklung CAR-modifizierter T- und NK-Zelltherapien und in nicht-viralen Gentransfer Technologien (Sleeping Beauty Transposon) ein. Ein weiterer Aufgabenbereich umfasst die Entwicklung pharmazeutischer Herstellungsprozesse für Immuntherapien als Basis für die klinische Prüfung.
Projektpartner
Universitätsklinikum Frankfurt (Koordination); Universitätsklinikum Würzburg (Koordination); Universitätsklinikum Freiburg

Das Fraunhofer IZI ist Mitglied in der European Rare Diseases Research Alliance (ERDERA).
Ziel des von der EU geförderten Konsortiums ist die Verbesserung der medizinischen Versorgung für Menschen, die mit einer seltenen Krankheit leben, durch koordinierte Forschung in den Bereichen Prävention, Diagnose und Behandlung von seltenen Erkrankungen.
Das Fraunhofer IZI bringt sich dabei mit seiner Expertise im Bereich der Prozessentwicklung und Herstellung mRNA, LNP und AAV-basierter Therapeutika ein. Das Engagement zielt insbesondere auf die Harmonisierung von Entwicklungs- und Herstellungsprozessen ab, um europaweit die Translation vielversprechender Forschungsergebnisse in die klinische Anwendung zu beschleunigen.
Ziel des Projekts ist die Entwicklung standardisierter und skalierbarer Prozesse für neuartige Gentransfermethoden für die Zell- und Gentherapieherstellung. Bei diesen Gentransfermethoden handelt es sich um Adeno-assoziierter Vektoren (AAV) als Genfähre für Gentherapien sowie um mRNA-Lipidnanopartikel (mRNA-LNP) für Zelltherapien.
Schwerpunkt ist die Entwicklung skalierbarer und GMP-konformer Herstellungsprozesse für Adeno-assoziierte Vektoren (AAV), die insbesondere bei Genersatztherapien zum Einsatz kommen können. Die Zusammenarbeit mit dem Industriepartner Cytiva führt dessen technische Ressourcen und Prozess-Know-how mit der wissenschaftlichen und verfahrenstechnischen Expertise des Fraunhofer IZI zusammen.
Ein weiterer Fokus liegt in der Erstellung eines GMP-konformen Herstellungsprozesses für mRNA-basierte, gegen CD19 gerichtete CAR-T-Zellen zur Behandlung schwerer Autoimmunerkrankungen. Dazu werden am Fraunhofer IZI mRNA-Moleküle entworfen und hergestellt. Der Kooperationspartner Cytiva unterstützt anschließend bei der Verkapselung der mRNA in Lipid-Nanopartikel sowie beim Upscaling der CAR-T-Zell-Generierung. Eine optimale Verkapselung ist notwendig, um die mRNA stabil und zielgerichtet in die T-Zellen zu überführen. Die so manipulierten T-Zellen sind anschließend dazu in der Lage, Immunzellen mit dem Oberflächenantigen (CD19) zu erkennen und eine entsprechende Immunantwort zu initiieren. Für den klinischen Einsatz solcher Therapien müssen alle Herstellungsschritte, vom Design der mRNA, über die Verkapselung bis zur Herstellung der Effektorzellen, standardisierbaren und skalierbaren Prozessen nach pharmazeutischen Standards entsprechen. Das Fraunhofer IZI bringt hierbei seine langjährige Expertise in der Entwicklung, Optimierung und Evaluation entsprechender Verfahren ein.
Partner
Cytiva

Ziel des Vorhabens ist die Erzeugung einer stabilen humanen Zelllinie zur effizienten, kostengünstigen und sicheren Herstellung klinischer Prüfmuster von Adeno-assoziierten viralen Vektoren (AAV). Hierzu erfolgt zunächst die Etablierung einer Masterzellbank basierend auf HEK293-Zelllen, die mittels lentiviralen Vektoren stabil transfiziert werden. Im nächsten Schritt wird ein stabiles Expressionssystem für die AAV-Vektor-Produktion entwickelt. Exemplarisch sollen innerhalb dieses Vorhabens die genetischen Informationen für den Serotyp AAV2 und ein Vektorkonstrukt, welches ein eGFP (enhanced green fluorescent protein) trägt, in die HEK293 Zellen eingebracht werden.
Die Zelllinie wird den regulatorischen Vorgaben der Good Manufacturing Practice (GMP) des EU-GMP Leitfadens erfüllen und damit eine ausreichend hohe Qualität haben, um als Ausgangsstoff für Medikamente eingesetzt zu werden.
Im Ergebnis wird ein verlässliches und effizient skalierbares System etabliert, das den hohen Qualitätsanforderungen der pharmazeutischen Industrie gerecht wird und die Produktion von AAV-Vektoren für den Einsatz in der Gentherapie optimiert.
Die Herstellung von Immuntherapien auf Basis von T-Zellen und Natürlichen Killerzellen (NK-Zellen) erfolgt hauptsächlich aus peripherem Blut, das durch Apherese von Patient*innen oder Spender*innen gewonnen wird. Um die gewonnenen Apheresate in ausreichender Menge für Forschungs- und Entwicklungsarbeiten zur Verfügung stellen zu können, ist ein standardisiertes und möglichst schonendes Einfrierverfahren erforderlich, das eine längere Lagerung und den qualitätssichernden Versand dieser Ausgangsprodukte ermöglicht. Ziel dieses Projekts ist es daher, ein optimiertes Verfahren zur Auftrennung und Kryokonservierung von Leukaphereseprodukten zu entwickeln, um den schnellen und kostengünstigen Zugang zu diesem wertvollen Ausgangsmaterial für die Entwicklung neuartiger zellbasierter Medikamente zu ermöglichen.
Am Fraunhofer IZI werden dafür frische Apheresate formuliert, in mehrere Portionen aufgeteilt und anschließend mit Hilfe eines optimierten Verfahrens kryokonserviert. Das frische Apheresat und die wieder aufgetauten Produkte werden auf deren zelluläre Parameter, zum Beispiel Zellzahl, Vitalität, Zusammensetzung und Funktionalität, hin analysiert und verglichen. Ein besonderer Fokus liegt dabei auf der Erhebung von Vergleichsdaten zum Phänotyp und der Fitness der primären T- und NK- Zellen. Dazu wird der Einfluss der Kryokonservierung auf die proliferative Kapazität und die zytotoxische Aktivität der therapeutisch interessanten Immunzellen untersucht.
Auftraggeber
Haema AG
Ziel des Vorhabens ist die Entwicklung innovativer Bestrahlungsprozesse für die Herstellung moderner Zell- und Gentherapeutika.
Die niederenergetische Elektronenbestrahlung (engl. Low Energy Electron Irradiation - LEEI) ist ein Bestrahlungsverfahren, dass zur effizienten Inaktivierung von Krankheitserregern (zum Beispiel Viren und Bakterien) und eukaryotischen Zellen geeignet ist. Die Inaktivierung basiert dabei auf der Zerstörung der Erbinformationen (Nukleinsäuren).
Das Verfahren ist patentiert und am Fraunhofer IZI befindet sich ein weltweit einzigartiger Forschungsprototyp, mit dem diese Bestrahlungstechnologie weiterentwickelt und auf verschiedenste Anwendungen adaptiert werden kann.
Im Rahmen des Projekts wird die niederenergetische Elektronenbestrahlung für zwei konkrete Anwendungsszenarien evaluiert. Untersuchungsstand des ersten Anwendungsszenarios ist die Bestrahlung von Leukozyten als Alternativverfahren bei der extrakorporalen Photophorese, bei der aktuell die Zellen mit ultravioletter Strahlung unter Zusatz eines Photosensibilisators (lichtaktivierbarer Wirkstoff) behandelt werden. Diese Therapie findet beispielsweise Anwendung bei der Spender-gegen-Wirt-Krankheit, der Hauptkomplikationen nach allogener hämatopoetischer Zelltransplantation. Bei Verwendung der niederenergetischen Elektronenstrahlung ist der Wirkstoffzusatz, der mit Nebenwirkungen verbunden ist, nicht notwendig.
Die zweite Anwendung adressiert die Herstellung NK-Zell-basierter Immuntherapeutika. Anders als Zelltherapeutika aus T-Effektorzellen (zum Beispiel CAR-T Zellen) müssen Natürliche Killerzellen mithilfe von Feederzellen aufwendig ko-kultiviert werden, um die klinisch benötigten Mengen therapeutischer Zellen zu erreichen. Werden Feederzellen in GMP-Herstellprozessen eingesetzt, wird deren Wachstum üblicherweise aus Sicherheitsgründen durch Bestrahlungsverfahren inhibiert. Die Eignung der LEEI als alternative Inaktivierungsmethode für Feederzellen wird in diesem Projekt untersucht.
Um an die ersten Erfolge T-Zell-basierter Krebsimmuntherapien anzuknüpfen und sowohl deren Anwendungsspektrum wie auch -breite zu erweitern, rückt eine weitere Art von Immunzellen in den Fokus biomedizinischer Forschung – Natürliche Killerzellen (NK-Zellen).
Im Gegensatz zu T-Zellen, eignen sich NK-Zellen aufgrund ihrer sicheren Übertragbarkeit zwischen gesunden Spenderinnen und Spendern und an Krebs erkrankten Personen auch für allogene Therapieformen. Dies ermöglicht eine standardisierbare und kosteneffiziente Vorratsproduktion, bei der die Produkte bedarfsgerecht abgerufen werden können.
Bevor allogene NK-Zellen als effizientes Medikament zum Einsatz kommen, müssen diese genetisch modifiziert und mit neuen Rezeptoren, die Krebszellen erkennen können, ausgestattet werden. Ein Fokus der strategischen Partnerschaft zwischen den Forschenden des Universitätsklinikums Oslo und des Fraunhofer-Instituts für Zelltherapie und Immunologie liegt dabei auf modifizierten T-Zell-Rezeptoren (TCR), die in der Lage sind, Fragmente intrazellulärer Krebsantigene auf HLA-I-Komplexen zu erkennen. Im Vergleich zu CAR (Chimeric Antigen Receptor)-T-Zellen, die nur Oberflächenantigene erkennen können, wird dadurch das Spektrum möglicher Zielantigene um ein Vielfaches erweitert.
Um entsprechende Forschungsergebnisse möglichst schnell in die klinische Anwendung zu überführen, werden bei sämtlichen Entwicklungsschritten die Prozesslösungen für die pharmazeutische Produktion direkt mitgedacht und berücksichtigt. Die Fraunhofer-Institute IZI und IPA (Institut für Produktionstechnik und Automatisierung) bringen hierbei ihre Erfahrung im Bereich der GMP-Prozessentwicklung und der Entwicklung von Automatisierungslösungen für die Herstellung von Zelltherapeutika ein.

Ziel von REANIMA ist es, neue Therapien für die Herzregeneration bereitzustellen. Es ist europaweit das erste Projekt, das in diesem Bereich Ergebnisse aus der Grundlagenforschung einbezieht, um diese in die medizinische Anwendung zu überführen. Das in Tiermodellen gewonnene Wissen soll umfassend analysiert werden, um so neue regenerative Therapien zur Behandlung von Herzinsuffizienz zu entwickeln. Das Projekt wird im EU-Programm Horizon 2020 gefördert. Das Fraunhofer IZI gehört dem Projektkonsortium an, das insgesamt zwölf europäische Partner vereint.
Projektkoordination
Centro Nacional de Investigaciones Cardiovasculares (CNIC)
Grant Agreement No
874764

Zell- und Gentherapien sind innovative Behandlungsmethoden, die kurative Ansätze für schwere, bisher nicht heilbare Krankheiten ermöglichen. Dazu zählen Therapien mit genetisch modifizierten Zellen als Arzneimittel für neuartige Therapien (ATMPs). Bei CAR-T-Zelltherapien werden patient*inneneigene T-Zellen mit chimären Antigenrezeptoren (CAR) modifiziert. Zugelassene sowie die Mehrheit, der sich in Entwicklung befindlicher, neuer CAR-T-Zellen basieren auf der stabilen gentechnischen Modifizierung patient*inneneigener Zellen mittels viraler Vektoren. Da die CAR-T-Zelltherapie eine sehr junge Methode ist, sind die Langzeitfolgen noch wenig untersucht. Des Weiteren kommt es durch persistente CAR-T-Zellen teilweise zu starken Nebenwirkungen. Eine Alternative zur stabilen Veränderung ist die vorübergehende Modifikation von Zellen mittels einer für das CAR-Protein kodierenden Boten-RNA (mRNA).
Ziel der Kompetenzplattform ist die Entwicklung von transienten CAR-Zelltherapeutika für die Behandlung von immun-mediierten Erkrankungen. Dazu werden neue mRNA-Techniken und Nanotransporter-Systeme entwickelt. Auf diese Weise sollen in einem Etablierungsprojekt CAR-T-Zellen gegen aktivierte Fibroblasten generiert werden. Zur Funktionstestung kommen humane 3D-Zellkultur- und Gewebemodelle der Fibrose sowie eine neuartige Imaging-Plattform zum Einsatz. Weiteres Ziel ist der Transfer der Technologie auf Natürliche Killer (NK)-Zellen, um Spender-unabhängige CAR-Zelltherapien zu entwickeln.
Weiterhin werden mittels der Plattform mRNA-basierte CAR-Zelltherapeutika entwickelt, die ein erhöhtes Sicherheitsprofil aufweisen. Damit entsteht ein transienter ATMP-Ansatz zur Behandlung von fibrotischen Erkrankungen. Um den zukünftigen Bedarf von CAR-Zelltherapien erfüllen zu können, wird der Übergang von autologen (patient*inneneigenen) zu allogenen (spender*innenfremden) Produkten gefördert, so dass mit einem Produktbatch möglichst viele Patient*innen behandelt werden können.
Bei Erfolg des Etablierungsprojekts sollen in Zusammenarbeit mit dem Fraunhofer ITEM weitere Ex-vivo-Modelle von fibrotischen Geweben für die Testung der CAR-Zellen eingesetzt werden. Zugleich soll die Plattform mittelfristig um andere zelltherapeutische Wirkweisen (z. B. T-Zellrezeptor-modifizierte Zellen) sowie andere Zielindikationen (z. B. Arthrose) erweiterte werden.
Die Markteinführung der ersten programmierten Killerzellen (Chimäre Antigenrezeptor (CAR)-tragende T-Zellen) erweiterten die therapeutischen Möglichkeiten von Blutkrebspatient*innen erheblich. Allerdings bleibt der Einsatz von CAR-modifizierten T-Zellen, aufgrund ihrer biologischen Eigenschaften, besonders bei der Behandlung solider Tumore hinter den Erwartungen zurück. Das liegt vor allem daran, dass die therapeutischen Zellen häufig nicht in der Lage sind bis in die Tumormasse vorzudringen. Hierbei ist bekannt, dass die Tumorumgebung (das sogenannte Mikromilieu) die Aktivität der programmierten Killerzellen hemmt. Um diese Herausforderungen aktiv anzugehen, wird die Eignung verschiedener Ausgangszellen zur Entwicklung neuer Zell- und Gentherapeutika geprüft. Im Rahmen dieses Projekts wird mitels CAR-Makrophagen ein neuer zellulärer Therapieansatz gegen bisher schwer behandelbare solide Tumore untersucht. Dazu werden Makrophagen aus humanem Spendermaterial isoliert und anschließend mit chimären Antigenrezeptoren (CAR) ausgestattet, die gegen prominente Tumorantigene gerichtet sind. Die Fähigkeit der CAR-Makrophagen Tumorzellen zu bekämpfen, soll dabei durch die Induktion und lokale Freisetzung von Typ-I-Interferonen (Typ1-IFNe) maximiert werden. Zudem wird erwartet, dass die Makrophagen das tumorigene Milieu des soliden Tumors in ein anti-tumorigenes Milieu umprogrammieren, um einen Tumorwachstummstopp zu erzwingen und die Tumorzellen gleichzeitig gegenüber Standardtherapien zu sensibilieren. Ihrer biologischen Funktion entsprechend können Makrophagen weiterhin: 1. Tumorzellen aktiv phagozytieren und 2. tumorspezifische Antigene präsentieren, die wiederum andere Immunzellen im Kampf gegen den Tumor aktivieren.
Die Nutzung von CAR-Makrophagen kann die Therapieoptionen für verschiedene Arten von Tumoren enorm erweitern. Anders als teure, patient*innenspezifische Zelltherapeutika können Makrophagen auch von Fremdspendern (als allogenes Produkt) genutzt und eingesetzt werden. Besonders Transportwege und -zeiten könnten so reduziert und die Verfügbarkeit der Therapien für betroffene Patient*innen signifikant gesteigert werden.
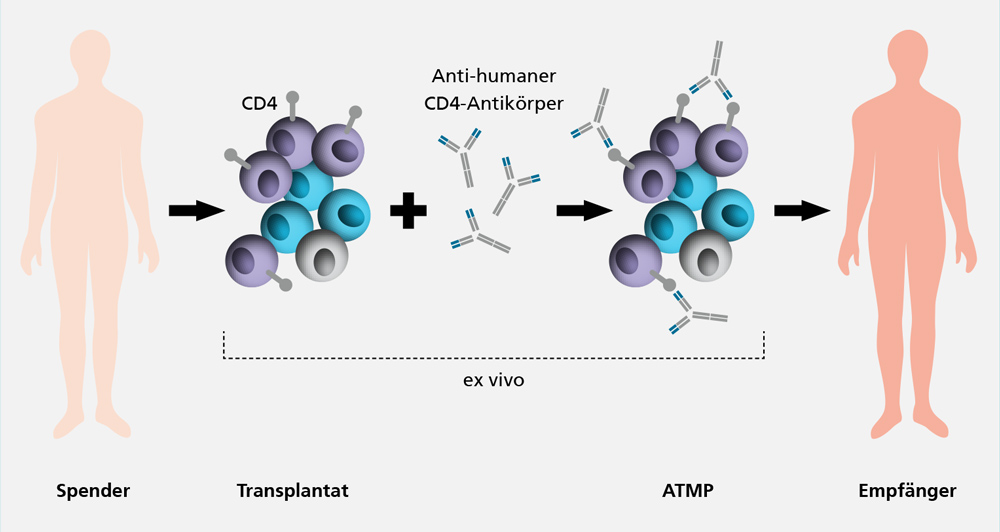
Die Transplantat-gegen-Wirt-Erkrankung (Graft-versus-host disease, GvHD) zählt mit einer Inzidenz von 30–40 Prozent zu den Hauptkomplikationen nach allogener hämatopoetischer Zelltransplantation. Herkömmliche Behandlungsmethoden zielen auf eine unspezifische Unterdrückung des gesamten Immunsystems ab, was das Risiko für Infektionen und Rezidive signifikant erhöhen kann. Zudem können die zu erwartenden Langzeiterfolge gering und sowohl mit hepato- als auch nephrotoxischen Nebenwirkungen vergesellschaftet sein. Das macht die Entwicklung weniger belastender Therapiealternativen dringend notwendig.
Die Abteilung Zell- und Gentherapieentwicklung erarbeitet Protokolle und Verfahren, um die Herstellung des ATMPs (Arzneimittel für neuartige Therapien) Palintra® zur Prävention der GvHD unter GMP-Bedingungen vorzubereiten. Durch Vorinkubation eines hämatopoetischen Zelltransplantats mit einem anti-humanen CD4-Antikörper werden unerwünschte Immunreaktionen gegen das Empfängergewebe nach Transplantation reduziert. Der anti-Tumoreffekt (GvL-Effekt), der vor der Entstehung eines Rezidivs schützt, bleibt jedoch erhalten.
Als Teil der präklinischen Entwicklungsphase wurden zellbasierte funktionelle Assays etabliert, welche erstmalig die Funktion dieses Immuntoleranz-induzierenden, anti-humanen CD4-Antikörpers in vitro messen können (Potency Assays). Mittels Next Generation Sequencing sollen zudem Veränderungen im Transkriptom von T-Zellen aufgedeckt und daraus der molekulare Wirkmechanismus des Antikörpers abgeleitet werden. Zusätzlich wird die Behandlungseffizienz von Palintra® zur GvHD-Prävention in vivo untersucht und mit konventionellen Therapien verglichen.
Neben der Erfüllung präklinischer, behördlicher Auflagen sind aus den aufgeführten Experimenten neue Erkenntnisse bzgl. immunologischer Prozesse in der Induktion von Immuntoleranz und bzgl. der GvHD möglich. Die Modelle und Erkenntnisse sind nicht nur für die hämatopoetische Zelltransplantation, z. B. zur Leukämiebehandlung, sondern auch für die Stammzelltransplantation bei anderen Indikationen (z. B. Autoimmunerkrankungen) von hohem Wert.

Zell- und Gentherapeutika, sogenannte Arzneimittel für neuartige Therapien (ATMP), besitzen ein sehr großes therapeutisches Potenzial. In der Hämatologie und Onkologie kommt beispielsweise die CAR-T-Zelltherapie seit 2018 in Deutschland zum Einsatz. Komplexe Logistikprozesse aus zentralen Produktionsstätten sowie unflexible Herstellungs- und Anwendungsschemata machen die Herstellung dieser Zelltherapeutika jedoch sehr zeit- und kostenintensiv. Im EU-Projekt »AIDPATH« (Artificial Intelligence-driven, Decentralized Production for Advanced Therapies in the Hospital) arbeiten Projektpartner aus Industrie und Forschung nun an der Entwicklung einer automatisierten und intelligenten Anlage, die in der Lage ist, eine zielgerichtete und patient*innenspezifische Zelltherapie direkt am Behandlungsort, also im Krankenhaus herzustellen. Zusätzlich befasst sich das Projekt mit der Integration der Anlage in das Krankenhausumfeld und berücksichtigt dabei Logistikprozesse sowie das Datenmanagement und die Datensicherheit.
Das Fraunhofer IZI bringt in das Vorhaben sein Know-how insbesondere in der Automatisierung der Herstellungsprozesse und der Anlagenvernetzung ein. Der Hauptstandort Leipzig ist schon seit längerem eine zentrale Herstellungs- und Entwicklungsstätte für ein CAR-T-Zelltherapeutikum, das zur Behandlung bestimmter Formen von Blutkrebs verwendet wird.
Das im Januar 2021 gestartete Projekt »AIDPATH« wird unter dem Förderkennzeichen 101016909 für vier Jahre im Rahmenprogramm der Europäischen Union für Forschung und Innovation Horizon 2020 gefördert.
AIDPATH-Projektkonsortium

Genetisch modifizierte Immunzellen sind dabei die Krebsmedizin zu revolutionieren. Insbesondere die CAR-T-Zelltherapie hat sich in den vergangenen Jahren (seit 2017 / 2018) als wertvolle Option zur Behandlung bestimmter Formen von Leukämie und Lymphomen etabliert.
Bei allen bislang zugelassenen CAR-T-Zellprodukten erfolgt die genetische Modifikation der Immunzellen mittels veränderter Viren. Diese werden als Transportvehikel genutzt, um die Gene für den therapeutisch relevanten CAR-Rezeptor dauerhaft in das Genom der Zielzelle zu integrieren.
Um diese Technologie weiterzuentwickeln, evaluieren Forschende des Fraunhofer IZI alternative Methoden zur genetischen Modifizierung von Immunzellen. Ziel ist die Erhöhung von Sicherheit und Effizienz der Therapie sowie die Erschließung weiterer Anwendungsgebiete zum Beispiel im Bereich der Autoimmunerkrankungen.
Der direkte Transfer von Boten-RNA (mRNA), als Vorlage zur Produktion therapeutischer Eiweißmoleküle in Zielzellen, ist eine der vielversprechendsten Alternative zur viralen Genmodifikation. Die größte Hürde für eine klinische Anwendung liegt dabei in dem Transport der mRNA zum Wirkort im Körper. Um dieser Herausforderung zu begegnen, wurde die Lieferung von mRNA mittels Nanocarrier optimiert, die so stabil »verpackte« mRNA sicher und effizient in die Zielzellen einzuschleusen. Im Zellinneren wird die mRNA freigesetzt und die Produktion der therapeutischen Moleküle begonnen.
Neben der Funktionalität und der optimalen Zusammensetzung wurden auch erste sicherheitsrelevante Untersuchungen auf Toxizität durchgeführt. Die erzielten Ergebnisse dienen nun als Basis für den nächsten Entwicklungsschritt, einer Proof-of-Concept Studie und Sicherheitsbewertung im Tiermodell. Das Projekt wird vom Bundesministerium für Bildung und Forschung gefördert.
Partner
Fraunhofer-Zentrum für Angewandte Nanotechnologie CAN

Die Transplantat-gegen-Wirt-Erkrankung (Graft-versus-Host Disease, GvHD) zählt mit einer Inzidenz von 30–60 Prozent zu den Hauptkomplikationen nach allogener hämatopoetischer Zelltransplantation. Herkömmliche Behandlungsmethoden zielen auf eine unspezifische Unterdrückung des Immunsystems ab, was das Risiko für Infektionen und Rezidive signifikant erhöhen kann. Umso wichtiger sind die Entwicklung neuer Wirkstoffe und Therapieansätze, die im besten Fall die Immunsystemfunktion der Patient*innen erhalten und Nebenwirkungen vermindern.
Seit einigen Jahren stehen Extrazelluläre Vesikel (EV) im Fokus verschiedener Forschungsansätze bei immunvermittelten entzündlichen Erkrankungen. Neben verschiedenen diagnostischen Anwendungen stehen insbesondere entzündungshemmende und immunmodulierende Effekte im Interesse der Forschung. Nahezu jede Zelle sezerniert EV und eine Vielzahl an Zellen nimmt diese wieder auf. Sie spielen dadurch eine elementare Rolle in der interzellulären Kommunikation und übernehmen beim Erhalt des physiologischen Gleichgewichts sowie bei der Pathogenese verschiedener Erkrankungen eine wichtige Rolle.
Die Vesikel, mit einer Größe von etwa 50 bis 2000 nm, transportieren eine Fülle an Biomolekülen (unter anderem Proteine, Nukleinsäuren, Lipide, Metabolite). In verschiedenen In-vitro- und In-vivo-Studien konnten immunregulierende Effekte beispielsweise durch EV aus Stammzellen beobachtet werden.
Im Auftrag der Lysatpharma GmbH (Eisenberg), welche ihren technologischen Schwerpunkt im Bereich der regenerativen Medizin und der Entwicklung von neuartigen Immuntherapien auf Basis von EV hat, evaluiert das Fraunhofer IZI das präventive und therapeutische Potenzial von EV in einem GvHD In-vivo-Modell (Maus). Die Lysatpharma GmbH wurde bei ihrer präklinischen Forschung und Produktentwicklung mittels einzelbetrieblicher Wirtschaftsförderung des Freistaats Thüringen (Projektnummer 2019 FE 0152 (EFRE)) unterstützt.
Die Herstellung von Immuntherapien auf Basis von T-Zellen und Natürlichen Killerzellen (NK-Zellen) erfolgt hauptsächlich aus peripherem Blut, das durch Apherese von Patient*innen oder Spender*innen gewonnen wird. Um die gewonnenen Apheresate in ausreichender Menge für Forschungs- und Entwicklungsarbeiten zur Verfügung stellen zu können, ist ein standardisiertes und möglichst schonendes Einfrierverfahren erforderlich, das eine längere Lagerung und den qualitätssichernden Versand dieser Ausgangsprodukte ermöglicht. Ziel dieses Projekts ist es daher, ein optimiertes Verfahren zur Auftrennung und Kryokonservierung von Leukaphereseprodukten zu entwickeln, um den schnellen und kostengünstigen Zugang zu diesem wertvollen Ausgangsmaterial für die Entwicklung neuartiger zellbasierter Medikamente zu ermöglichen.
Am Fraunhofer IZI werden dafür frische Apheresate formuliert, in mehrere Portionen aufgeteilt und anschließend mit Hilfe eines optimierten Verfahrens kryokonserviert. Das frische Apheresat und die wieder aufgetauten Produkte werden auf deren zelluläre Parameter, zum Beispiel Zellzahl, Vitalität, Zusammensetzung und Funktionalität, hin analysiert und verglichen. Ein besonderer Fokus liegt dabei auf der Erhebung von Vergleichsdaten zum Phänotyp und der Fitness der primären T- und NK- Zellen. Dazu wird der Einfluss der Kryokonservierung auf die proliferative Kapazität und die zytotoxische Aktivität der therapeutisch interessanten Immunzellen untersucht.
Auftraggeber
Haema AG
Ziel des Vorhabens ist die Entwicklung innovativer Bestrahlungsprozesse für die Herstellung moderner Zell- und Gentherapeutika.
Die niederenergetische Elektronenbestrahlung (engl. Low Energy Electron Irradiation - LEEI) ist ein Bestrahlungsverfahren, dass zur effizienten Inaktivierung von Krankheitserregern (zum Beispiel Viren und Bakterien) und eukaryotischen Zellen geeignet ist. Die Inaktivierung basiert dabei auf der Zerstörung der Erbinformationen (Nukleinsäuren).
Das Verfahren ist patentiert und am Fraunhofer IZI befindet sich ein weltweit einzigartiger Forschungsprototyp, mit dem diese Bestrahlungstechnologie weiterentwickelt und auf verschiedenste Anwendungen adaptiert werden kann.
Im Rahmen des Projekts wird die niederenergetische Elektronenbestrahlung für zwei konkrete Anwendungsszenarien evaluiert. Untersuchungsstand des ersten Anwendungsszenarios ist die Bestrahlung von Leukozyten als Alternativverfahren bei der extrakorporalen Photophorese, bei der aktuell die Zellen mit ultravioletter Strahlung unter Zusatz eines Photosensibilisators (lichtaktivierbarer Wirkstoff) behandelt werden. Diese Therapie findet beispielsweise Anwendung bei der Spender-gegen-Wirt-Krankheit, der Hauptkomplikationen nach allogener hämatopoetischer Zelltransplantation. Bei Verwendung der niederenergetischen Elektronenstrahlung ist der Wirkstoffzusatz, der mit Nebenwirkungen verbunden ist, nicht notwendig.
Die zweite Anwendung adressiert die Herstellung NK-Zell-basierter Immuntherapeutika. Anders als Zelltherapeutika aus T-Effektorzellen (zum Beispiel CAR-T Zellen) müssen Natürliche Killerzellen mithilfe von Feederzellen aufwendig ko-kultiviert werden, um die klinisch benötigten Mengen therapeutischer Zellen zu erreichen. Werden Feederzellen in GMP-Herstellprozessen eingesetzt, wird deren Wachstum üblicherweise aus Sicherheitsgründen durch Bestrahlungsverfahren inhibiert. Die Eignung der LEEI als alternative Inaktivierungsmethode für Feederzellen wird in diesem Projekt untersucht.
Die Einführung der CAR-T-Zelltherapie zur Behandlung verschiedener Krebserkrankungen markierte einen wichtigen Meilenstein für den Einsatz von zellulärer Immuntherapien in der Onkologie.
Neben großen Hoffnungen, dass diese vielversprechende Therapieform möglichst schnell für unterschiedlichste Krebsarten verfügbar wird, sind mit zunehmenden Patientenzahlen auch diverse Herausforderungen assoziiert. Hierzu zählt, dass CAR-T Zellprodukte patientenindividuell und in einem Aufwändigen Herstellungsprozess produziert werden müssen. Eine begrenzte Verfügbarkeit und hohe Therapiekosten sind die Folge.
Neben optimierten Herstellungsprozessen, stehen deshalb auch alternative Immuntherapien im Fokus internationaler Forschungsbemühungen.
Natürliche Killerzellen (NK-Zellen) gelten als vielversprechende Ressource, um Kosteneffizienz und Verfügbarkeit von Krebsimmuntherapien zu optimieren. Nach dem gleichen Prinzip genetisch modifiziert wie CAR-T-Zellen, werden CAR-NK Zellen in die Lage versetzt Tumorzellen zu erkennen und gezielt zu zerstören. Im Gegensatz zu T-Zellen, sind NK-Zellen nicht immunogen. Sie können demnach auch von gesunden Spendern auf Patienten übertragen werden, ohne immunologische Abstoßungsreaktionen hervorzurufen. NK- und auch CAR-NK-Zellprodukte können somit kosteneffizienter und in größerem Maßstab produziert werden.
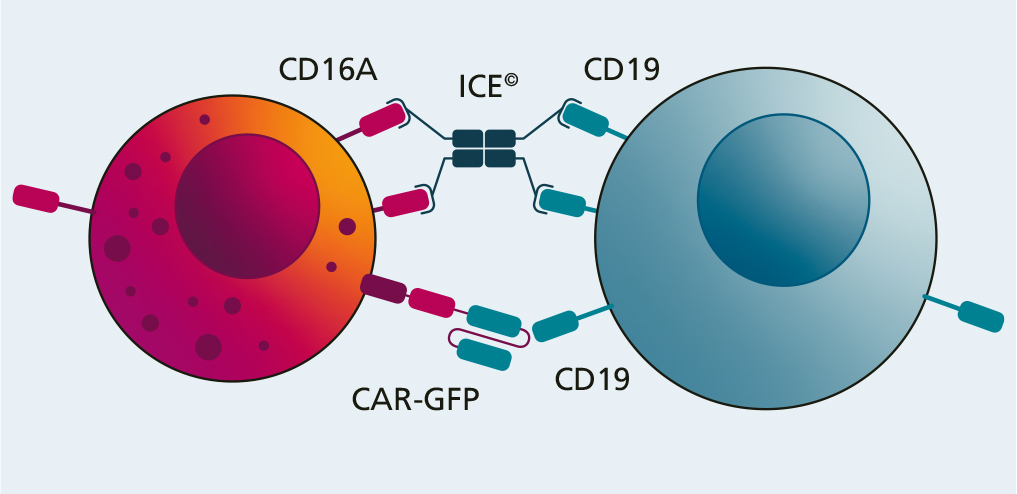
Im Auftrag der Affimed GmbH (Mannheim), wurde am Fraunhofer IZI das Potenzial einer Kombinationstherapie aus NK-Zellprodukten und sogenannten Innate Cell Engagern (ICE) untersucht.
Diese ICE-Moleküle binden sowohl an NK-Zellen als auch an Tumorzellen, indem sie an den CD16A-Rezeptor auf den Immunzellen und ein spezifisches Antigen (CD19) auf den Tumorzellen binden. Sobald diese Brücke hergestellt ist, wird die Immunzelle aktiviert und zerstört die Tumorzelle.
Im Rahmen dieses Projektes wurde die antitumorale Wirksamkeit zweier Kombinationstherapien (NK-Zellen und CAR-NK-Zellen jeweils mit ICE kombiniert) im Vergleich zur einfachen CAR-NK-Zelltherapie in verschiedenen in vitro Experimenten untersucht. Dabei konnte gezeigt werden, dass das zytotoxische Potenzial der Kombinationstherapie der einfachen Therapie überlegen ist. Ein signifikanter Unterschied zwischen den beiden Kombinationen (NK-Zelle + ICE vs. CAR-NK-Zelle + ICE) konnte hingegen nicht beobachtet werden. Die Verwendung von ICE in Kombination mit einer NK-Zelltherapie hat somit das Potenzial zu einer erfolgreichen Krebsimmuntherapie, was jedoch in weiterführenden präklinischen und klinischen Studien vertieft untersucht werden muss.
Ziel des Projekts ist die GMP-konforme Herstellung eines monoklonalen Antikörpers für die klinische Studie zur Verhinderung der Graft-versus-Host-Disease (GvHD) bei der allogenen Stammzelltransplantation.
Das Projekt beinhaltet folgende Arbeitspakete:
Bislang ist häufig keine Heilung für die Augenkrankheit Glaukom (Grüner Star) möglich, die im schlimmsten Fall zum Verlust der Sehkraft führen kann. Aktuell angewandte Behandlungen und chirurgische Methoden sind oft nicht effektiv, wenig erfolgreich und teilweise auch nicht gut verträglich. Deshalb sind neue Therapien für die ständig wachsende Zahl an Patient*innen mit grünem Star – insbesondere durch eine dauerhafte Senkung des Augeninnendrucks – notwendig. Dazu zielen innovative Moleküle hinsichtlich ihrer Wirksamkeit auf die Reduktion der Augenhypertonie und somit zur Reduktion des Verlustes der Sehkraft.
Das Unternehmen Mannin Inc. hat ein neues rekombinantes Protein (Ang1 mimetic) entwickelt, das für die Therapie des Glaukoms zum Einsatz kommen soll. Es handelt sich dabei um einen spezifischen und potenten Aktivator der Tie2-Rezeptortyrosinkinase. Die Behandlung mit Ang1 mimetic soll bei Glaukom-Patient*innen den Flüssigkeitsabfluss aus dem Auge erhöhen und somit zu einer Reduktion des Augeninnendrucks führen. Dadurch kann die fortschreitende Schädigung der retinalen Ganglionzellen aufgehalten werden, was zur Heilung des grünen Stars führen würde.
Im Zusammenhang mit Entzündungen und Infektionskrankheiten wie COVID-19 (verursacht durch eine SARS-CoV-2-Infektion) ist die Tie2-Aktivierung wichtig bei der Aufrechterhaltung der Endothelfunktion und der vaskulären Barriere. Defekte in vaskulären Endothelzellen, bedingt durch Apoptose, Quieszenz oder weitere biologische Prozesse, resultieren in vaskulärer Durchlässigkeit und einer damit verbundenen Pathologie wie akuter respiratorischer Luftnot (ARDS, Acute Respiratory Distress Syndrome). Viele aktuelle Therapien für COVID-19 und ähnliche Infektionskrankheiten fokussieren auf antivirale Ansätze. Die Nutzung des neuen rekombinanten Proteins stellt einen Wirt-assoziierten Ansatz dar und zielt auf eine Stabilisierung des Endothels ab, was die Auswirkung von ARDS reduzieren würde.
Ziel des Projekts ist es daher, einen GMP-konformen Herstellungsprozess (konkret Zelllinien, Masterzellbänke, Upstream- und Downstream-Prozessentwicklung) des Fusionsproteins Ang1 mimetic einschließlich der notwendigen Qualitätskontrollen am Fraunhofer IZI zu etablieren, um eine klinische Anwendung des Biomoleküls zu ermöglichen.