Außenstelle Extrakorporale Therapiesysteme
ADsorb – Entwicklung eines implantierbaren Systems zur Liquorpherese bei neurologischen Erkrankungen am Beispiel der Alzheimer Demenz
Die Alzheimer-Demenz (AD) gehört bis heute zu den größten medizinischen Herausforderungen für unsere Gesellschaft. Bisher kann die Krankheit weder geheilt noch wirksam in ihrer Progression aufgehalten werden.
Mit den wesentlichen Symptomen wie Gedächtnisverlust und den zum Teil starken Wesensveränderungen korreliert eine Anreicherung von intrazerebralen Beta-Amyloid im zentralen Nervensystem (ZNS) und Liquor. Eine Abreicherung dieses neurotoxischen Proteins durch die Liquorpherese erscheint daher als möglicher Therapieansatz. Das Verfahren orientiert sich an extrakorporalen Blutreinigungsmethoden, die insbesondere in der Therapie des akuten und chronischen Nieren- und Leberversagens sowie bei Autoimmunerkrankungen etabliert sind. Diese Methoden basieren auf der gezielten Reduktion pathogener Moleküle, die sich andernfalls in Geweben akkumulieren und zur Krankheitsprogression beitragen würden. In diesem Zusammenhang könnte die Liquorpherese dazu beitragen, eine alters- oder krankheitsbedingte Dysfunktion des Liquorsystems auszugleichen und dadurch den Krankheitsverlauf zu verlangsamen oder bestenfalls aufzuhalten.
Ziel des Projekts ist die Entwicklung und Erforschung einer Technologie zur Liquorpherese, um spezifische, im ZNS generierte Targetproteine aus dem Liquor zu entfernen. Hierfür wird zunächst ein Modellsystem in der transgenen Alzheimer-Maus entwickelt, um ein miniaturisiertes, implantierbares Liquorpheresedevice zu testen. Das Fraunhofer IZI bringt hierbei seine Expertise im Bereich der extrakorporalen Technologien und Adsorber ein.
Partner
Universitätsmedizin Rostock; Universität Rostock
Förderung
Go-Bio initial Programm / Bundeministerium für Bildung und Forschung

Pathologisches Blut-Hirn-Schranken-Modell für die Entwicklung neuartiger Therapiestrategien
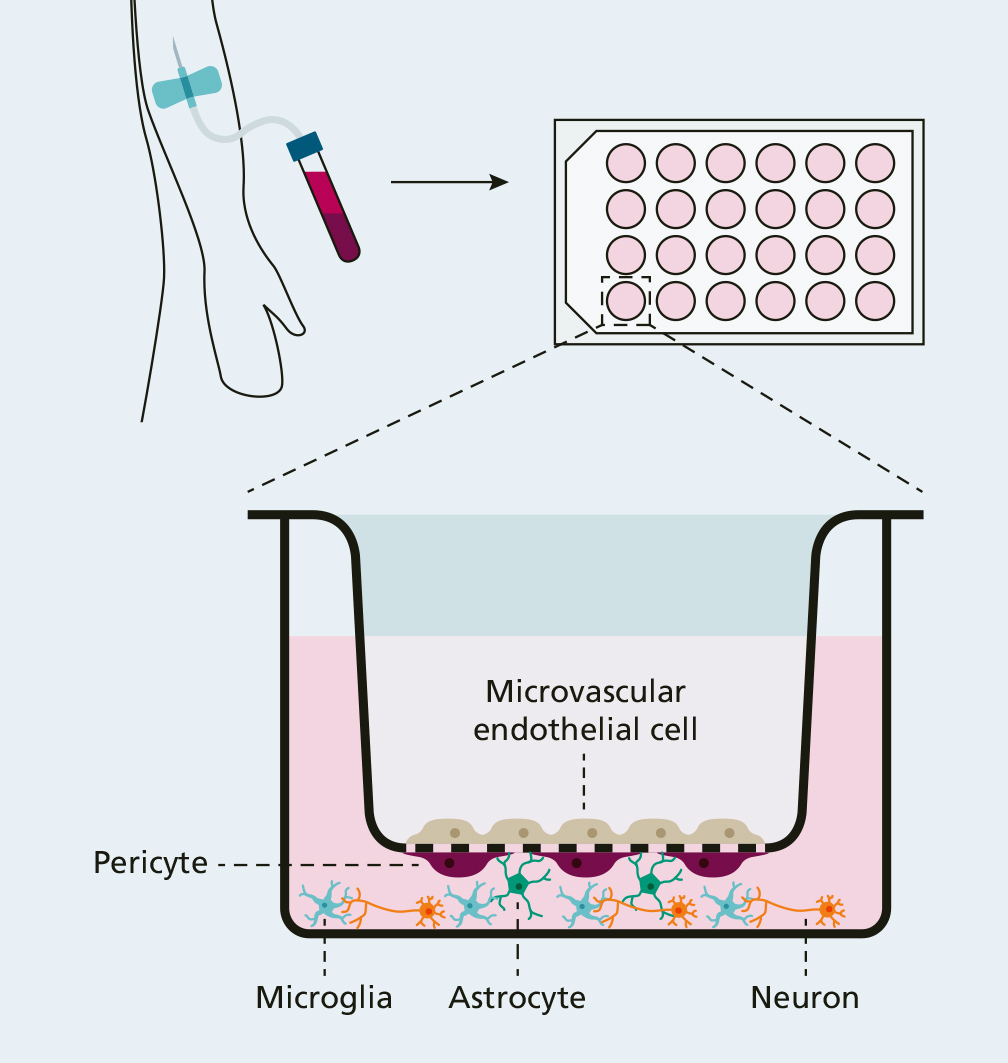
Die Blut-Hirn-Schranke stellt eine der dichtesten Schutzbarrieren des Körpers dar. Sie schützt das sensible zentrale Nervensystem sowohl vor zytotoxischen Einflüssen als auch vor aus dem Blut stammenden Pathogenen. Diese Barriere setzt sich aus mikrovaskulären Endothelzellen, Perizyten und Astrozyten zusammen, welche mit Neuronen und Mikroglia eine neurovaskuläre Einheit bilden.
Bei einer systemischen Erkrankung wie einer Sepsis, also einer Blutvergiftung, wird diese Barriere jedoch durch die hohe Ansammlung von Schadstoffen im Blut geschwächt und es können langfristige neurologische Folgeschäden auftreten. So leiden über die Hälfte der von Sepsis betroffenen Patient*innen selbst ein Jahr nach ihrer Erkrankung noch an kognitiven und psychologischen Folgeerkrankungen. Durch die hohe Komplexität der pathophysiologischen Vorgänge im Körper konnten bislang keine gezielt neuroprotektiven Therapieansätze für Patient*innen mit einer akuten Sepsis oder Organversagen entwickelt werden.
Das Fraunhofer IZI entwickelt in Kooperation mit der Universitätsmedizin Rostock ein humanes In-vitro-Krankheitsmodell der Blut-Hirn-Schranke basierend auf induzierten Pluripotenten Stammzellen (iPS). Dabei werden die Zelltypen der neurovaskulären Einheit – Endothelzellen, Perizyten, Astrozyten, Neurone, Mikroglia – durch gezielte Differenzierungen aus Stammzellen generiert. In einem Transwellsystem werden diese in physiologischer Anordnung zusammengeführt und somit die »gesunde« Blut-Hirn-Schranke modelliert. Mittels Inkubation mit Plasmen von Patient*innen mit Sepsis oder mit Organversagen können pathologische Zustände simuliert werden, unter denen die Blut-Hirn-Schranke geschädigt wird.
Die Schädigungen können anschließend untersucht und zellulär wie molekularbiologisch charakterisiert werden. Ziel des Projektes ist die Etablierung eines aussagekräftigen Zellmodells für die Entwicklung von protektiven Wirkstoffen und Medikamenten.
Das Vorhaben wird von der Damp-Stiftung gefördert.
Partner
Universitätsmedizin Rostock; NeuroProof Systems GmbH
Ex-situ-Perfusion von Organen
Die Verfügbarkeit von geeigneten Spenderorganen für Patient*innen mit Organversagen ist seit vielen Jahren ein großes Problem. Einerseits ist das Spendenaufkommen selbst zu gering – geschätzt können nur etwa 10 Prozent des tatsächlichen Bedarfs mit transplantierten Organen versorgt werden. Andererseits entspricht die Funktionsfähigkeit von gespendeten Organen bzw. der Gesundheitszustand von potenziellen Spender*innen häufig nicht den medizinischen Erfordernissen. Vorerkrankungen von Spender*innen, das Vorliegen von Risikoparametern, insbesondere bei Lebern zum Beispiel ein hoher Verfettungsgrad, aber auch die Dauer der Ischämiezeit (fehlende Blut- und Sauerstoffversorgung des Organs während des Transports) nach der Organentnahme können zu erheblichen Funktionseinbußen des Organs führen. Solche »marginalen« Organe bedeuten zumeist eine geringere Überlebenswahrscheinlichkeit der transplantierten Patient*innen oder werden als Spenderorgan erst gar nicht in Betracht gezogen. Aufgrund des hohen Bedarfs an gespendeten Organen gibt es jedoch den zunehmenden Wunsch, auch marginale Organe für Transplantationen zu berücksichtigen.
An dieser Stelle setzt das Projekt OrganFit an. Aus publizierten Arbeiten ist bereits bekannt, dass Organe mit Hilfe einer Maschinenperfusion über einen gewissen Zeitraum funktionsfähig gehalten werden können. Erfolgt die Perfusion dann bei physiologischen Temperaturen (»normotherm«) ist die Funktionserhaltung gegenüber hypothermen Bedingungen verbessert, da die kalte Ischämiezeit reduziert wird. Mit der in der Abteilung Extrakorporale Therapiesysteme aufgebauten Organperfusionsplattform sollen nun weitere Ansätze untersucht werden, die die Verwendung von marginalen Lebern unterstützen sollen. Dafür sind sowohl technische als auch biologische Ansätze vorgesehen, mit denen das natürliche Regenerationspotenzial von Lebern genutzt werden soll. Für die Etablierung und Erprobung dieser Ansätze werden dabei zunächst Lebern aus Schweinen verwendet. Das Projekt erfolgt in enger Kooperation mit der Klinik für Transplantationschirurgie und der Klinik für Anästhesie und Intensivmedizin der Universitätsmedizin Rostock.
Über das laufende Projekt hinaus soll die technische Plattform zudem neue Kooperationen und weitere Forschungsprojekte ermöglichen und damit die Chancen einer Ex-situ-Organperfusion möglichst vielfältig nutzen.
Kryoregeneration von Dialysewasser
Patient*innen, die aufgrund einer chronischen Erkrankung der Nieren im Spätstadium keine ausreichende körpereigene Entgiftungsfunktion mehr haben, müssen sich regelmäßig einer Dialyse unterziehen. Das Prinzip dieses Verfahrens ist seit Jahrzehnten etabliert und beruht auf der Extraktion wasserlöslicher Giftstoffe (Urämietoxine) in einem extrakorporalen Filter, dem Dialysator. Der Giftstoffübertritt aus dem Blut in das reinigende Dialysewassser (Dialysat) geschieht innerhalb des Dialysators über eine Membran. Pro Dialysebehandlung, die in der Regel vier Stunden dauert und dreimal pro Woche wiederholt wird, werden etwa 120 l Dialysat benötigt. In Kliniken und spezialisierten Dialysepraxen wird dieses Wasser durch Umkehrosmoseanlagen bereit gestellt. Diese benötigen nicht nur viel Platz und Energie, sondern vor allem kann das Wasser auch nur einmal verwendet werden, da es nach der Dialyse als Abwasser verschwindet. Bezogen auf ein Jahr und 90 000 Patient*innen in Deutschland benötigt man mehr als 1,7 Millionen Kubikmeter hochreines Wasser, wobei das verlorene RO-Wasser in dieser Menge noch nicht berücksichtigt ist.
Mit einem für die Dialyse bisher nie realisierten Ansatz wird in der Abteilung Extrakorporale Therapiesysteme ein Verfahren erarbeitet, welches die Regeneration dieses benutzten Dialysewassers ermöglicht und damit das große Problem der Wasserabhängigkeit der derzeitigen Dialysepraxis erheblich verändern könnte. Dieses Verfahren basiert auf der aus der Getränkeindustrie bekannten Gefrierkonzentration und nutzt das Prinzip, dass die Kristallgitterstruktur von gefrorenem Wasser alle zuvor gelösten Fremdsubstanzen ausschließt. In einem automatisierbaren Kreislaufprozess lässt sich damit verunreinigtes Dialysat in reines Wasser und ein kleines Restvolumen mit allen Verunreinigungen trennen. Das Restvolumen können die Patient*innen durch ihr natürliches Trinken nachliefern, wodurch die Dialyse wasserunabhängig wird und vollständig mobile Lösungen denkbar werden. Dass diese Trennung unabhängig von Stoffeigenschaften wie Löslichkeit, Polarität, Größe, Dichte etc. erfolgt, ist ein sehr großer Vorteil gegenüber allen konventionellen filterbasierten Verfahren, die vor allem gegenüber Harnstoff keine ausreichende Filterleistung zeigen.
Das Verfahren befindet sich in der Patentierung. Aktuell wird eine automatisierte Lösung entwickelt. Mit dieser technischen Lösung sollen dann umfangreiche Untersuchungen durchgeführt werden, die genaue Prozessparameter liefern, um auf die erste klinische Anwendung hinzuarbeiten. Das Interesse namhafter Industrieunternehmen an diesem Verfahren konnte aber schon jetzt geweckt werden.
Pressemitteilung
3D Gewebemodellsysteme
Dieses Projekt ist ein Teilprojekt im Verbundvorhaben HOGEMA: »Erforschung neuartiger Ansätze zur Bereitstellung verbesserter Gewebeersatzmaterialien auf Basis der hydrostatischen Hochdruckbehandlung«.
Dabei werden die Projektpartner der Universität Rostock, der Universitätsmedizin Greifswald, der Hochschule Wismar, des Fraunhofer IZI sowie der Universitätsmedizin Rostock neuartige Ansätze zur Bereitstellung verbesserter Gewebeersatzmaterialien auf Basis der hydrostatischen Hochdruckbehandlung erforschen.
Die Abteilung Extrakorporale Therapiesysteme des Fraunhofer IZI wird die Anwendbarkeit der hydrostatischen Hochdrucktechnologie auf Weichgewebe wie Nieren oder Darm von Nagetieren untersuchen. Dabei geht es um die Generierung von Gewebegerüsten mit einer deutlich verbesserten Matrixintegrität, als dieses mit nasschemischen Verfahren möglich ist. Durch die anschließende Wiederbesiedlung der Gerüste mit humanen Zellen können diese Modelle für eine Vielzahl von medizinischen, pharmakologischen und biotechnologischen Untersuchungen genutzt werden.
Weiterführende Informationen zum Forschungsverbund »HOGEMA«: hogema.med.uni-rostock.de
Die Förderung des Projekts erfolgt aus Mitteln des Europäischen Sozialfonds (ESF) im Rahmen des Qualifikationsprogrammes »Förderung von Nachwuchswissenschaftler*innen in exzellenten Forschungsverbünden - Exzellenzforschungsprogramm des Landes Mecklenburg-Vorpommern«.
Förderkennzeichen: ESF/14-BM-A55-0012/18


Dieses Projekt wird/wurde kofinanziert von der Europäischen Union aus dem Europäischen Fonds für regionale Entwicklung.
Operationelles Programm Mecklenburg-Vorpommern 2014-2020 - Investitionen in Wachstum und Beschäftigung
Nierengewebemodelle
Von chronischen Nierenerkrankungen (CKD) sind mittlerweile ca. zehn Prozent der Weltbevölkerung betroffen. Die derzeitigen Behandlungsoptionen umfassen Dialyse und Nierentransplantation, die jedoch aus verschiedenen Gründen sowohl medizinisch als auch für das Patient*innenwohl unbefriedigend sind. Die Möglichkeit, zukünftig durch künstliche (bioartifizielle) Nieren eine dritte Option zu erhalten, wäre daher in jedem Fall ein erheblicher Gewinn. Mit Forschungsansätzen aus dem Bereich Tissue Engineering sind auch immer wieder beeindruckende Fortschritte erzielt worden, der Weg hin zu funktionalen Nieren scheint jedoch sehr lang zu sein. In diesem Projekt sollen vor allem Gewebemodellsysteme etabliert werden, mit denen sich gezielter verschiedene Fragestellungen zur effizienten Dezellularisierung und nachfolgenden Rezellularisierung von Nierengewebe aus Ratten adressieren lassen. Nach Entfernung der tierischen Zellen verbleibt eine Extrazellulärmatrix (ECM) als ein filigranes, anatomisch intaktes Gerüst (Scaffold), welches Basis für die Besiedlung mit humanen Zellen ist. Beide Prozesse, sowohl die Entfernung der ursprünglichen Zellen, als auch die Wiederbesiedlung mit humanen Zellen sind jedoch komplexe Prozesse, die im Detail erheblich optimiert werden können. Bislang überwiegend genutzt zur Dezellularisierung wird die Perfusion des Organs mit chemischen Reagenzien, welche allerdings auch zu einer erheblichen Beeinträchtigung der Qualität und Integrität des verbleibenden Scaffolds führen kann. Erstmalig in diesem Projekt wird die Anwendung von hydrostatischer Hochdruckbehandlung (HHD) auf den Dezellularisierungsprozess untersucht. HHD kann zu einer sehr schnellen und effektiven Devitalisierung der Zellen führen, so dass eine nachfolgende Perfusion verkürzt und damit weniger schädigend für die ECM ist, was für die Rezellularisierung von erheblichem Vorteil wäre. Neben intakten Nieren werden hier insbesondere auch Nierenschnitte (»precision cut kidney sections«) untersucht, die sich als 3D-Gewebemodellsystem hervorragend eignen.
Diese Art von Gewebemodellen sollen schließlich für eine Reihe von Fragestellungen genutzt werden, von der genauen Untersuchung der zellulären und molekularen Prozesse bei der Rezellularisierung, über Funktionsanalysen von Nephronen, wie auch pharmakologischen Problemstellungen. Das Projekt wird gefördert im Rahmen der Landesexzellenzinitiative Mecklenburg-Vorpommern (HOGEMA Konsortium). Beteiligt an dem Forschungsverbund Gewebeersatzmaterialien sind die Universitäten Rostock, Greifswald und die Hochschule Wismar.


MedTech – Weitere Projekte im Bereich Medizintechnik
Im Bereich MedTech werden innovative Therapien, vor allem mit dem Ziel das Immunsystem zu unterstützen, entwickelt und getestet. Ausgehend von klassischen extrakorporalen Technologieplattformen wie Dialyse und Plasmaseparation werden neue Behandlungsansätze entwickelt. Ein besonderer Akzent liegt auf der Entwicklung extrakorporaler Blutbehandlungsverfahren zur Sepsistherapie und die Entwicklungen von Erweiterungssystemen für die Dialyse.
Entwicklung des Extracorporeal Immune Support System (EISS)
Weltweit erkranken jährlich über 18 Millionen Menschen an einer schweren Sepsis. Alleine in Deutschland sterben jedes Jahr bis zu 60 000 Menschen an dieser Krankheit. Aus diesem Grund hat die Abteilung Extrakorporale Therapiesysteme in Zusammenarbeit mit der Artcline GmbH ein Zell-Bioreaktorsystem entwickelt und evaluiert, mit welchem man die Sepsis durch Immunzellen (Granulozyten) gesunder Spender*innen behandeln kann. Hierbei wird das Patient*innenplasma extrakorporal in einem Bioreaktor mit einem Granulozytenkonzentrat eines*einer blutgruppenkompatiblen Spenders*Spenderin umspült. Bei diesem Prozess werden bakterielle Toxine und andere inflammatorisch wirksame Stoffe durch Phagozytose aus dem Blutplasma entfernt, so dass das gereinigte Patient*innenplasma anschließend zurück in den Kreislauf der Patient*innen geführt werden kann. Erste klinische Ergebnisse zeigen, dass es neben der Abreicherung von bakteriellen Bestandteilen auch zu einer deutlichen Verbesserung der zellulären Immunkompetenz der Patient*innen kommt. Zeitnah sollen weitere klinische Studien mit angepassten Parametern erfolgen.
Granulozyten-Aufreinigung
In diesem Projekt wird daran gearbeitet, die Aufreinigung von Granulozyten, die für das Extracorporeal Immune Support System benötigt werden, zu optimieren. Ein wesentliches Ziel hierbei ist die Verlängerung der Lagerungszeit unter den aktuellen Bedingungen der Transfusionsmedizin. Bisher sind Granulozytenkonzentrate nur max. 24 Stunden bei 20–24 °C lagerbar. Eine Steigerung der Haltbarkeit der Granulozytenkonzentrate würde die Flexibilität der durchzuführenden Therapien im Klinikalltag und die Spendenlogistik deutlich verbessern. Weiterhin können derzeit keine reinen Granulozytenkonzentrate hergestellt werden, da das Präparat bei der Apherese durch einen gewissen Eintrag von Erythrozyten und Thrombozyten kontaminiert wird. Daher ist ein weiteres Ziel in diesem Projekt, humane Blutpräparate so aufzubereiten, dass eine möglichst reine Granulozytenfraktion gewonnen werden kann, um diese optimal klinisch bzw. therapeutisch nutzen zu können.
Zytokinadsorber
Sepsis, im Volksmund auch Blutvergiftung, ist eine komplexe systemische Entzündungsreaktion des Organismus. Ausgelöst wird diese meist durch Bakterien und deren Toxine, wenn diese in den Blutkreislauf gelangen. Dabei kommt es zu einer heftigen Abwehrreaktion des Immunsystems, die sich teils auch gegen den eigenen Körper richtet. Bei schweren Verläufen führt diese zu hoher Anfälligkeit für sekundäre Infektionen sowie Multiorganversagen. Die Häufigkeit von Sepsis und ihrer schweren Verlaufsformen nimmt weltweit stetig zu. Bei schweren Formen der Sepsis liegt die Letalität daher trotz aller modernen intensivmedizinischen Versorgungsmöglichkeiten auch heute noch bei mehr als 50 Prozent. Dabei sind eine schnelle Diagnose und Einleitung einer effektiven antibiotischen Therapie, essentielle Faktoren, die über Leben und Tod entscheiden können. Um die Prognose der Patient*innen zu verbessern, können zudem verschiedene unterstützende Therapieansätze wie zum Beispiel Nierenersatz- oder adsorptive Verfahren eingesetzt werden. Ein wichtiges adsorptives Verfahren ist die Hämoperfusion. Hierbei wird Patient*innenblut extrakorporal durch eine Kartusche geleitet, in der sich ein Adsorptionsmittel befindet. Die verschiedenen kommerziell erhältlichen Adsorber zielen entweder auf die Entfernung von Toxinen (Lipopolysaccharide) oder von Entzündungsmediatoren (Zytokine / Chemokine) ab, die während der Überreaktion des Immunsystems vermehrt ausgeschüttet werden. In Zusammenarbeit mit der CytoSorbents Europe GmbH wurde ein solcher Zytokinadsorber (CytoSorb) untersucht. CytoSorb-Adsorbersäulen sind in Europa als unterstützende extrakorporale Sepsis-Therapie zugelassen. Mit diesen Säulen sollen vorrangig während der initialen Abwehrreaktion pro- und anti-inflammatorische Botenstoffe aus dem Blut entfernt werden. Da die Adsorption jedoch nicht spezifisch erfolgt, wurde untersucht, ob und in welchem Ausmaß verschiedene intensivmedizinisch relevante Medikamente wie etwa Antibiotika und weitere Substanzen wie etwa Schmerz- und Beruhigungsmittel, Herzkreislaufmedikamente und Gerinnungshemmer, vom Adsorber zurückgehalten werden. In den In-vitro-Studien konnte unter anderem gezeigt werden, dass der untersuchte Adsorber in großem Maße Gerinnungshemmer (Rivaroxaban) aus dem Blut entfernt. Dieses Ergebnis ist von direkter klinischer Relevanz. Patient*innen, die den Gerinnungshemmer einnehmen und auf eine Notoperation angewiesen sind, können nicht operiert werden, bevor der Wirkstoff vollständig ausgeschieden ist. Dies kann jedoch bis zu acht Stunden dauern. Mit dem Adsorber könnte diese Wartezeit signifikant verkürzt und wertvolle Therapiezeit gewonnen werden. Weitere Untersuchungen zur Entfernung verschiedener interessanter Substanzklassen sollen 2018 folgen.
CellTech – Weitere Projekte im Bereich Zell- und Biotechnologie
Der Bereich CellTech konzentriert sich auf die Evaluierung therapeutischer und toxischer Effekte (Hepatotoxizität) von neuartigen Wirkstoffkomponenten mit Hilfe von In-vitro- und In-vivo-Modellen.
Biosensorik zur Vermeidung oder Früherkennung eines Leberversagens
Das Leberversagen ist mit einer hohen Sterblichkeitsrate verbunden und kann durch akute Lebererkrankungen oder durch die Verschlechterung einer bestehenden Lebererkrankung verursacht werden. Jedoch können auch Medikamente, wie zum Beispiel Paracetamol ein akutes Leberversagen auslösen. Medikamentös bedingte Leberschäden sind die häufigste Ursache für die Rücknahme von bereits für den Markt zugelassenen Medikamenten. Jedoch gibt es derzeit kein zuverlässiges Testsystem zur Früherkennung eines Leberversagens. Aus diesem Grund wurde ein auf humanen Leberzellen basierenden Mikrotiterplattenassay entwickelt, der zur Früherkennung des Leberversagens in der Klinik und zur Evaluierung der Toxizität von Medikamenten- und Medizinprodukten verwendet werden kann. Durch die Optimierung und Standardisierung des Verfahrens können zuverlässige Aussagen bezüglich exogener, aber auch endogener Toxizität gemacht werden.
Tonmineralien bei der Behandlung von CKD und CED
Der Einsatz von Tonmineralien stellt einen innovativen Therapieansatz zur Behandlung von chronisch-entzündlichen Darmerkrankungen (CED) dar. Eine umfassende Charakterisierung der therapeutischen und prophylaktischen Potenziale der einzusetzenden Tonmineralien erfolgt derzeit mithilfe von zellbasierten Modellen und in tierexperimentellen Studien. Neben den positiven therapeutischen und prophylaktischen Effekten bei CED, konnte bereits belegt werden, dass die Tonmineralien kein Toxizitätspotenzial besitzen. Es wird angenommen, dass die eingesetzten Tonmineralien darmbarrierestärkende Effekte, wie antioxidatives Potenzial, sowie die Fähigkeit zur Bindung von Endotoxin besitzen und somit die Behandlung von CED unterstützen.
Eine weitere Einsatzmöglichkeit ist die Verwendung der Tonmineralien als Phosphatbinder bei Patient*innen mit chronischen Nierenerkrankungen (chronic kidney disease, CKD). Bei niereninsuffizienten Patient*innen kommt es häufig zu stark erhöhten Phosphatkonzentrationen im Blutserum, was zu kardiovaskulären Erkrankungen führen kann. Um dem entgegenzuwirken, wird in einem neuen Therapieansatz die Phosphatbindekapazität der Tonmineralien in Bezug auf die Prävention der kardiovaskulären Erkrankungen untersucht. Derzeit wird mithilfe eines In-vitro-Verkalkungsmodells humaner koronarer arterieller Muskelzellen (human coronary artery smooth muscle cells, HCASMC) und in tierexperimentellen Studien mit chronisch-niereninsuffizienter Ratten (5/6 Nephrektomie, 5/6 NX) das Therapiepotenzial analysiert.
ECOS – Study Center for Extracorporeal Methods and Biosimulations
Um die wissenschaftlichen Konzepte der Projektgruppe zügig in klinische Anwendungen zu überführen, wurde das Studienzentrum ECOS in die Gruppe integriert. Das Studienzentrum widmet sich zum einen der Umsetzung eigener wissenschaftlicher Konzepte und Entwicklungen in die Praxis und zum anderen führt es in enger Kooperation mit der Universitätsmedizin Rostock (UMR) sowie den Kliniken der Region präklinische und klinische Studien im Bereich der medizinischen Extrakorporaltherapien und -systeme für Industriepartner durch. Gegenstand der Forschung sind sowohl interventionelle als auch nicht-interventionelle Studien mit Arzneimitteln und Medizinprodukten. Dabei umfasst unsere Kompetenzkette alle Aspekte klinischer Prüfungen, von der Planung über Durchführung und Monitoring bis zur biometrischen Auswertung und Publikation. Ein weiterer Forschungsschwerpunkt liegt auf der Analyse der Verbreitung, Ursachen und Verläufe sowie Einflussfaktoren und Wechselwirkungen von Erkrankungen im Indikationsgebiet auf Basis von klinischen und repräsentativen Bevölkerungsdaten.
Gegenwärtig ist ECOS in eine multizentrische klinische Studie eingebunden, die die Wirksamkeit und Sicherheit des extrakorporalen Leberunterstützungssystems ELAD® (Extracorporeal Liver Assist Device) bei Patient*innen mit schwerer alkoholischen Hepatitis untersucht. In zwei weiteren Beobachtungsstudien wird die Effektivität des Einsatzes unterschiedlicher Adsorber bei der Albumindialyse bzw. zur Behandlung von Patient*innen mit schwerer Sepsis untersucht.



