
Experimentelle Bildgebung

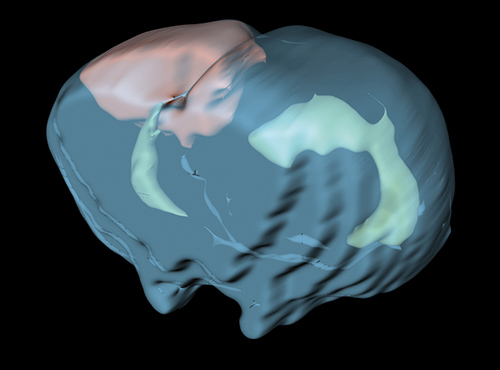
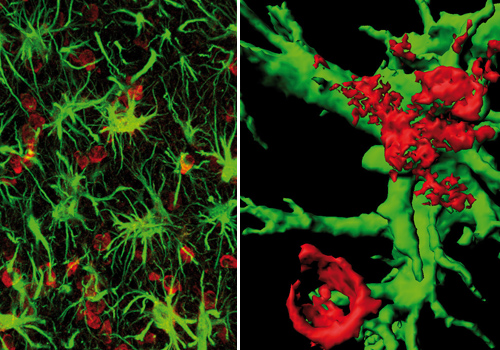
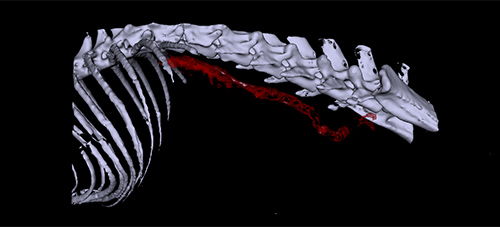
Den Lebenswissenschaften steht eine Vielzahl von Bildgebungsmethoden zur Verfügung. Die dafür eingesetzten Verfahren nutzen eine große Bandbreite des elektromagnetischen Spektrums, das sich von kurzwelliger Röntgenstrahlung (Computertomographie) über das für den Menschen sichtbare Licht (Mikroskopie) bis zum Radiofrequenzbereich (Magnetresonanztomographie) erstreckt. Jedes dieser Verfahren kann sehr spezifisch Strukturen oder biologische Prozesse im lebenden Organismus darstellen.
Der Fokus der Arbeitsgruppe Experimentelle Bildgebung liegt auf der Erarbeitung von Lösungen zur Bildgebung, die von Partnern aus Forschung und Industrie adressiert werden. Neben der reinen Datenaufnahme werden auch Projekte bis hin zur Geräteentwicklung umgesetzt. In interdisziplinären Konsortien dient die Arbeitsgruppe als Schnittstelle zwischen Ingenieurs- und Lebenswissenschaften.
Folgende Technologien zur experimentellen Bildgebung stehen am Fraunhofer IZI zur Verfügung:
- Hellfeldmikroskopie von Objektträgern und automatisiertes Slide Scanning
- Spezialisierte Fluoreszenz- und Laser-Scanning-Mikroskopie
- Lebendzellmikroskopie zur Visualisierung biologischer Prozesse in vitro
- Laser-Mikrodissektion zur Gewebe- oder Zellisolation
- Hochfeld 7T-Magnetresonanztomographie (MRT) im Kleintierscanner
- Biolumineszenz- (BLI) und Fluoreszenzbildgebung (FLI) von Kleintieren
- Computer Tomographie (CT) mit anschließender Planung und Durchführung der Bestrahlung
Im Rahmen einer institutsweiten Vernetzung bioanalytischen Methoden können weitere Techniken, wie Massenspektrometrie, Durchflusszytometrie und DNA-Sequenzierung zur Begutachtung biologischer Proben hinzugezogen werden. Nähere Informationen dazu und eine detaillierte Geräteübersicht befinden sich auf den Seiten der Technologieplattform Advanced Analytics.