Contact Press / Media
Dr. Natalia Sandetskaya
Wissenschaftliche Mitarbeiterin AG MicroDiagnostics
Fraunhofer-Institut für Zelltherapie und Immunologie IZI
Perlickstr. 1
04103 Leipzig
Telefon +49 341 355369310
Fax +49 341 355369930
Das Ziel dieses Projekts ist die Evaluierung der wirtschaftlichen Erfolgsaussichten für die innovativen Anwendungen der regional hergestellten speziellen Materialien in der In-vitro-Diagnostik. Faserbasierte und / oder poröse Materialien, welche ihre primären Anwendungen ursprünglich in der Herstellung von Textilwaren oder Baumaterialien finden, könnten viele vorteilhafte Eigenschaften für die Probenvorbereitung in der Labordiagnostik aufweisen. Ihre Implementierung für die neuen Zwecke würde einen optimalen Raum für Innovation in Diagnostik und Materialherstellung bieten und gleichzeitig einen neuen Markt für die Materialienhersteller in Sachsen erschließen.
Etwa 75% aller Fälle von Gebärmutterhalskrebs sind auf das Humane Papillomvirus zurückzuführen. Zur Prävention existieren bereits Impfungen, die jedoch nicht flächendeckend wahrgenommen werden und ferner nur wirksam sind, sofern vorher keine persistierende Infektion stattgefunden hat. Ein schneller, günstiger und zuverlässiger Test könnte die Gesundheitssysteme also einerseits durch Stratifizierung der zu impfenden Personen entlasten und andererseits das Bewusstsein für die Dringlichkeit von Vorsorgeuntersuchungen schärfen, wodurch Infektionen und Krebsfälle früher erkannt und erfolgreicher behandelt werden können.
Ziel des Projekts ist die Entwicklung eines Point-of-Care-Tests, der Probenmaterial aufnimmt und die Nukleinsäuren der viralen Erreger freisetzt. Diese werden in einer isothermalen Amplifikation vervielfältigt, wobei die benötigte Temperatur mit Hilfe einer exothermen chemischen Reaktion erzeugt und aufrechterhalten wird. Im Anschluss wird das Resultat der Nachweisreaktion für den Anwender mit bloßem Auge ablesbar sein. Die Kartusche soll zudem aus einem nachhaltigen Material gefertigt werden, das aus nachwachsenden Rohstoffen hergestellt bzw. kompostierbar ist.
Das Fraunhofer IZI bringt hierbei seine Expertise bei der Probenaufbereitung und der Entwicklung molekularbiologischer Schnelltests ein.
Das Universitätsklinikum Leipzig mit seiner Poliklinik für Frauenheilkunde (UKL) als klinischer Partner im Unterauftrag involviert und wird neben medizinischer Expertise auch klinische Proben von Patientinnen mit HPV-Infektion einbringen, um in einer Proof-of-Concept Studie die Funktionalität des Systems zu evaluieren.
Projektpartner
INTU Diagnostics GmbH (Koordination); VOXDALE GmbH; Universitätsklinikum Leipzig AöR; Institut für Molekulare Diagnostik und Bioanalytik (IMDB) gGmbH
Point-of-Care-Diagnostika (zum Beispiel Corona-Schnelltests) werden in der Regel für einen breiten Einsatz außerhalb spezialisierter medizinischer Einrichtungen konzipiert und meist in hohen Stückzahlen produziert. Hierbei kommen überwiegend Einwegmaterialien aus erdölbasierten Kunststoffen zum Einsatz. Der enorme Rohstoffverbrauch, fehlende Recycling-Möglichkeiten und die kaum abbaubaren Materialien führen zunehmend zu massiven Umweltproblemen.
Biobasierte und bioabbaubare Kunststoffe wären eine deutlich nachhaltigere Alternative. Neuartige biobasierte Kunststoffe (zum Beispiel PLA, HNA, TPS) sind in der Regel anspruchsvoller in der Verarbeitung und kommen deshalb in der Diagnostikindustrie bislang kaum zum Einsatz.
Ziel des Projekts ist die Entwicklung eines geeigneten biobasierten, gegebenenfalls bioabbaubaren Werkstoffs sowie die Etablierung entsprechender Prozessketten und Herstellungsverfahren für dessen Verarbeitung. Am Beispiel eines Hepatitis D Point-of-Care Schnelltests werden die grundsätzliche Eignung und Funktionalität dieses Materials untersucht.
Das Fraunhofer IZI bringt hierbei seine Expertise in der Entwicklung und Validierung molekularbiologischer und immunologischer Tests sowie mikrofluidischer Systeme ein. Das Institut verantwortet im Rahmen des Projekts die Entwicklung eines Lateral-Flow-Assays zum schnellen und zuverlässigen Nachweis von Virusproteinen und Antikörpern in Serum oder Plasma. Dabei werden auch regulatorische Aspekte zur Zulassung von diagnostischen Medizinprodukten bereits in der Entwicklungsphase berücksichtigt.
Projektpartner
Hochschule für Technik und Wirtschaft Dresden (Koordination); Otto Injection Molding GmbH & Co. KG; Roboscreen GmbH; Bergi-Plast GmbH; Fraunhofer-Institut für Werkzeugmaschinen und Umformtechnik IWU
Ziel des Projektes ist die Entwicklung eines einfach zu handhabenden Testsystems zur Vor-Ort-Analyse (Point-of-Care) klinisch relevanter Biomarker im Blut. Ähnlich einer Blutzuckermessung soll die Analyse vollautomatisch und anhand weniger Blutstropfen erfolgen.
Der Detektionsansatz basiert dabei auf einer vom Max-Planck-Institut für medizinische Forschung entwickelten Klasse von biolumineszenten synthetischen Sensorproteinen, die bei Anwesenheit des Analyten die Farbe des emittierten Lichts ändern. Dieses Licht kann durch eine leistungsstarke Kamera, wie sie heute auch schon in Mobiltelefonen verwendet wird, erfasst und über das Verhältnis der emittierten Lichtfarben quantifiziert werden.
Eine der Kernaufgaben des Fraunhofer IZI innerhalb des Projektes war die Entwicklung einer Mikrofluidik-basierten Testplattform mit automatisierter Probenverarbeitung. Diese sollte so konstruiert sein, dass nur wenige manuelle Pipettier- oder Verdünnungsschritte notwendig sind und das Verfahren somit auch für Laien benutzerfreundlich ist. Innerhalb des Testsystems müssen dazu neben den Biosensoren auch die notwendigen Reagenzien mittels Gefriertrocknung in einer chemisch stabilen Form vorgelegt werden. Der Probentransport erfolgt ausschließlich durch Kapillarkräfte, wodurch der Einsatz von Elektronik und Mechanik und minimiert wird. Dies senkt Herstellungskosten und erhöht Mobilität und Systemstabilität.
Zur Herstellung der mikrofluidischen Kartuschen wurden zunächst drei verschiedene Verfahren evaluiert, 3D-Druck, Flexodruck und Heißprägung, wobei sich letzteres als das geeignetste Verfahren herausgestellt hat.
Auf dieser mikrofluidischen Test-Plattform wurde anschließend ein Assay zur Analyse von Nicotinamid-Adenin-Dinukleotid (NAD+) implementiert. NAD+ spielt eine wesentliche Rolle in verschiedenen biochemischen Prozessen. Ein Rückgang des NAD+-Gehalts wurde mit verschiedenen Pathologien und dem physiologischen Altern in Verbindung gebracht, während Strategien zur Steigerung des zellulären NAD+-Spiegel in vielen Tiermodellen gegen altersbedingte Krankheiten wirksam waren.
In der letzten Phase des Projektes wird der Assay anhand von Patient*innenproben validiert.
Das Projekt wird im Rahmen des Max-Planck-Fraunhofer-Kooperationsprogramms finanziert.
Projektpartner
Max-Planck-Institut für medizinische Forschung; Fraunhofer-Institut für Angewandte Optik und Feinmechanik
In den letzten Jahren ist das Interesse an extrazellulären Vesikeln (EVs) enorm gestiegen. Der Grund dafür ist ihre Eigenschaft, ein aktuelles Abbild ihrer Ursprungszelle für den Moment der Freisetzung widerzuspiegeln. Dies könnte ein vielversprechender diagnostischer Ansatz in der Flüssigbiopsie sein, welcher in unserer Gruppe untersucht wird. Denn obwohl EVs gerade mal eine Größe von ca. 30 nm bis zu wenigen Mikrometern aufweisen, findet sich eine Fülle an molekularen Bestandteilen (unter anderem Proteine, Nukleinsäuren, Lipide, Metabolite) in ihnen. Diese potenziellen Biomarker werden von der umgebenen Lipiddoppelschicht vor extrazellulären Abbauprozessen geschützt. Außerdem werden EVs kontinuierlich von nahezu allen Zellen sekretiert und finden sich folglich in allen Körperflüssigkeiten (zum Beispiel Blutplasma, Urin oder Speichel). Dadurch ist eine nicht- bzw. minimal-invasive Isolation möglich und Gewebebiopsien könnten zukünftig vermieden werden.
Mit Hilfe eines Antikörper-Microarrays, der am Fraunhofer IZI etabliert wurde, konnte die Expression verschiedener EV-Oberflächenmarker in Bezug auf Tumorerkrankungen aus unterschiedlichen Körperflüssigkeiten analysiert werden. Diese Ergebnisse fließen in die Arbeit der Anreicherung von gewebs- oder krankheitsspezifischen EVs mit ein. Ziel ist die vergleichsweise kleine Population an krankheitsrelevanten EVs von dem breiten Hintergrund von »gesunden« EVs abzutrennen und dessen Bestandteile zu untersuchen. Obwohl ein Zusammenhang zu den Tumorzellen zu erwarten ist, könnten sich zusätzlich veränderte Profile zeigen, die diagnostische oder therapierelevante Entscheidungen zukünftig verbessern oder sogar erst ermöglichen.
Ziel des Vorhabens ist die Erforschung von Anwendungen der molekularen Akustik für die quantitative und qualitative Klassifizierung von Blut, Blutplasma und Dialysefiltraten. Hierbei wird ermittelt, wie sich ausgesandte akustische Wellen in Körperflüssigkeiten ausbreiten. Daraus ergeben sich spezifische Charakteristiken, die kleinste Unterschiede in der Zusammensetzung des untersuchten Mediums abbilden. Ferner wird charakterisiert, inwieweit in vivo eingesetzte Multisensorsysteme zerstörungsfreie Echtzeitanalysen realisieren und somit bestehende Diagnoseverfahren in Geschwindigkeit und Präzision übertreffen können. Neben akustischen Sensoren sollen dabei auch optische und magnetische Sensoren zum Einsatz kommen.
Die Diagnostik von Krankheiten soll möglichst schnell, einfach und kostengünstig sein, durchführbar direkt am Point-of-care ohne hochqualifiziertes Laborpersonal und zudem ohne zusätzliche Belastung für die Patient*innen. Um den hier bestehenden Bedarf zu decken, wird am Fraunhofer IZI und am Fraunhofer-Zentrum MEOS an einem Diagnostikverfahren unter Nutzung der Ausatemluft geforscht.
Klinisch wird die Atemgasanalyse bereits seit Jahren im Rahmen von Lungenfunktionstests oder dem Harnstoff-Atemtest zum Nachweis von Helicobacter pylori-Infektionen eingesetzt. Jedoch steckt ein viel größeres Potenzial in der Atemgasdiagnostik. Es gibt Tausende von sogenannten volatile organic compounds (VOCs – flüchtige organische Substanzen), deren Zusammensetzung in der Atemluft sich bei bestimmten Erkrankungen und Infektionen verändert. Bekannt ist zum Beispiel der Geruch von Diabetes-Patient*innen nach überreifem Obst, hervorgerufen durch eine stark erhöhte Konzentration von Aceton, einer VOC.
Die meisten VOCs treten in extrem niedrigen Konzentrationen auf (ein Teilchen auf 1 Million bis Billion Teilchen). Dies stellt extreme Anforderungen an die Messtechnik. Herkömmlich werden meist massenspektroskopische Verfahren eingesetzt, die jedoch einen enorm hohen apparativen Aufwand bedeuten. Der Fokus liegt daher auf der Ionenmobilitätsspektrometrie (IMS), die mit einer gaschromatographischen (GC) Vortrennung gekoppelt ist. Diese Technologie ist wesentlich preiswerter, portabler (Schuhkarton-Größe) und wird bereits für Drogen- und Sprengstoffkontrollen eingesetzt.
Im Rahmen des Projekts ist es gelungen, mittels GC-IMS verschiedene Bakterien nach nur 90 Minuten Kultivierung im Labor anhand ihres VOC-Profils voneinander zu unterscheiden. Diese Erfahrungen werden nun genutzt, um reale Atemproben in der Klinik direkt zu untersuchen. Ziel ist es, verschiedene bakterielle und virale Infektionserkrankungen, inklusive eventuell vorhandener Medikamenten-Resistenzen, in der Atemluft von Patient*innen zu diagnostizieren.
Im Fraunhofer-Zentrum MEOS in Erfurt arbeiten Kolleg*innen vom Fraunhofer IZI und Fraunhofer IPMS gemeinsam an einem neuartigen IMS-System. Dessen Kernstück ist ein kleiner IMS-Silizium-Chip, der am Fraunhofer IPMS in Dresden weiterentwickelt wird. Potenziell lassen sich mittels der mikroelektronischen Herstellungsverfahren miniaturisierte IMS-Chips kostengünstig in großen Stückzahlen herstellen. Das neue System soll an der Diagnostik von neurologischen Erkrankungen sowie Krebs erprobt werden. Dabei stehen neben der Ausatemluft auch andere nicht-invasiv gewonnene Proben wie Schweiß und Urin im Fokus.
Erklärung des IMS-Messverfahrens, welches am Fraunhofer-Zentrum MEOS entwickelt wird. Videoumsetzung © 3D Agentur Berlin, Dirk Puder und Stefan Loth, GbR
Die ZDF-Wissenschaftsreihe Leschs Kosmos berichtet in der Folge »Gesunde Kranke? Im Netz der Diagnostik« (Erstausstrahlung 1. Juni 2021) über die Forschungsarbeiten am Fraunhofer-Zentrum MEOS zur Diagnostik mittels Ausatemluft (Minute 17:40 bis 21:00).
Die Ausatemluft enthält Substanzen, sogenannte volatile organic compounds (VOCs), die Aussagen über den Stoffwechsel zulassen. Bei einer Vielzahl von Erkrankungen, darunter Infektionen, Krebs bis hin zu neurodegenerativen Erkrankungen, ändert sich der Stoffwechsel und damit die Zusammensetzung der ausgeatmeten VOCs. Die Erfassung dieser VOCs bietet die Chance, Krankheiten frühzeitig und nicht-invasiv zu diagnostizieren.
Die Ionenmobilitätsspektrometrie (IMS) kann VOCs innerhalb weniger Minuten direkt am Point-of-care detektieren. Im Rahmen des BMBF-Projektes »Breath Alert« wird untersucht, ob IMS zur Erkennung von Antibiotikaresistenzen bei Bakterien eingesetzt werden kann. Im Fraunhofer-versus-Corona Clusterprojekt »M3Infekt« konnte am Fraunhofer-Zentrum für Mikroelektronische und Optische Systeme für die Biomedizin MEOS die IMS-Technologie unter Beteiligung des Fraunhofer IZI weiterentwickelt werden. Konkret wurden Methoden zur Probenahme über Mund und Nase, zur kurzzeitigen Probenkonservierung sowie zur Probenvorbereitung etabliert und erprobt. Am Projektende konnte das Verfahren an 60 gesunden Probanden im Rahmen von zwei Studien am Universitätsklinikum Dresden und Städtischen Klinikum Magdeburg getestet werden. Parallel dazu wurde am Fraunhofer MEOS ein funktionsfähiger neuartiger IMS-Demonstrator fertiggestellt. Dieser muss nun in Folgeprojekten so weiterentwickelt und optimiert werden, dass Diagnostik-relevante VOCs in komplexen Matrices wie Atemluft selektiv detektiert werden können.
Im Projekt »M3Infekt« wurden durch die beteiligten Fraunhofer-Einrichtungen weitere nicht-invasive und mobil einsetzbare Sensoren u.a. zur Erfassung von Herzrate, EKG, Sauerstoffsättigung, Atemfrequenz und Atemvolumen weiterentwickelt. Konzepte zur Systemintegration und flexible Schnittstellen wurden definiert und ein multimodales KI-Framework zur sensorübergreifenden Datenauswertung entwickelt. Darüber hinaus wurden Anforderungen hinsichtlich der Konformität zur medizinischen Regulatorik erarbeitet. Die übergeordnete Vision des Projekts ist ein engmaschiges Monitoring der relevanten klinischen Parameter für die Erkennung von Zustandsverschlechterungen bei Infektionskrankheiten auch außerhalb von Intensivstationen über ein multimodales, modulares und mobiles Sensorsystem. Während der Projektlaufzeit hat sich ergeben, dass mehrere spezifische Lösungen für verschiedene Teilanwendungen sinnvoller als ein einziges Gesamtsystem sind und somit der Nutzen der Projektergebnisse sogar erhöht wird.
Die Weltgesundheitsorganisation beschreibt in ihrem Fachbericht eindringlich, warum die Bekämpfung von Antibiotikaresistenzen zu den großen Aufgaben der Weltgemeinschaft zählt. Bis zum Jahr 2050 rechnet die Organisation jährlich mit 10 Millionen Todesfällen, die auf Infektionserreger zurückzuführen sein werden [1]. Nicht nur für die therapeutische Behandlung, sondern auch die diagnostische Erkennung der krankheitsauslösenden Erreger sind Innovationen notwendig, um der Herausforderung im Gesundheitswesen entgegen zu steuern.
Um diese Situation zu verbessern, zielt das Ende 2020 gestartete Projekt BreathAlert auf ein neues Verfahren zum schnellen und nicht-invasiven Nachweis von Infektionserregern sowie vorliegenden Antibiotika-Resistenzen, welches die Atemluft von Patient*innen analytisch untersucht. Im Projekt steht eine Weiterentwicklung der Ionenmobilitätsspektrometrie im Fokus, die eingesetzt werden soll, um volatile organische Substanzen (VOCs) von Mikroorganismen zu charakterisieren.
Am Fraunhofer IZI wird an ausgewählten Mikroorganismen untersucht, ob diese über abgegebene VOCs differenzierbar und den jeweiligen Bakterienarten zuzuordnen sind. Dazu werden die Erreger zunächst kultiviert und anschließend der headspace, die Gasphase über dem Kulturmedium, in das Gerät geleitet. Die VOCs werden ionisiert, im elektrischen Feld getrennt und anschließend zeitlich versetzt detektiert. Eine Software analysiert die komplexen Daten. Ziel ist es, spezifische Signale zu identifizieren, mit denen Bakterien auch unter verschiedenen Bedingungen sicher voneinander zu unterscheiden sind. Im Fokus stehen antibiotikaresistente Erreger, wie zum Beispiel Enterobakterien, die in zunehmendem Maße Carbapenem- sowie Cephalosporin-Resistenzen zeigen [1].
Die Charakterisierung klinischer Isolate, Atemluftproben infizierter Patient*innen sowie Messungen zum Einfluss von beispielsweise Ernährungsgewohnheiten auf die Atemluft von Menschen, runden das Projekt ab.
Als Konsortialpartner arbeitet das Unternehmen Graupner medical solutions GmbH, das die medizinische Gerätetechnik entwickelt, gemeinsam mit dem Fraunhofer IZI zusammen. Unterstützt werden die Entwicklungsarbeiten von Fachkliniken, die Zugang zu Proben ermöglichen als auch eine abschließende Validierung durchführen. Wirtschaftlich verwertet werden die Projektergebnisse durch das Unternehmen Graupner.
[1] World Health Organization Report 2017: Prioritization of Pathogens to guide discovery, research and development of new antibiotics for drug-resistant bacterial infections, including tuberculosis. WHO/EMP/IAU/2017.12.

Die Probenvorbereitung ist ein entscheidender Aspekt in vielen Bereichen der bioanalytischen Forschung, insbesondere in der Analyse komplexer Proben und / oder seltener, niedrig konzentrierter Zielmoleküle. Moderne Labors nutzen sehr empfindliche Nachweisverfahren, einschließlich der Molekulardiagnostik; jedoch hängt ihre Leistung stark von der Qualität der Probe ab. Für den wirksamsten Nachweis der Zielmoleküle muss die Probe analytisch vorbereitet werden. Das beinhaltet die Reinigung der Probe und ihre Vorkonzentration sowie parallel die Entfernung der Verbindungen, die die Analyse beeinträchtigen könnten. Das Konservieren von Proben, die den Abbau der Zielmoleküle verhindern, ist ebenso Aufgabe dieses Gebiets der angewandten Analytik. Das Hauptziel der Probenvorbereitung ist es, die Genauigkeit und Effizienz der nachfolgenden Analyse zu gewährleisten. Keiner der Ansätze zur Probenvorbereitung ist universell: Zu berücksichtigen sind stets die Verfahren zur Weiterverarbeitung der Probe, die Konzentration und Art, das Volumen der Probe und viele anderen Faktoren.
Heutzutage verfolgt die bioanalytische Forschung aktiv die Integration von komplexen Tests auf automatisierten Plattformen, darunter Lab-on-Chip-Geräte. Dieser Trend lässt oft intelligente Lösungen für die Schritte bei der Voranalyse und -behandlung vermissen. Das Ziel unserer Arbeitsgruppe ist es, diesen bestimmten Bereich durch die Entwicklung der am besten geeigneten Ansätze zur Probenvorbereitung für spezifische Bedürfnisse voranzubringen.
Die Gruppe unterstützt Forscher*innen und Industriepartner mit maßgeschneiderten Lösungen, wertet Kapazitäten der bestehenden Methoden aus und entwickelt neue Strategien für die effektive Verarbeitung bei der Probenvorbehandlung.
Einfache Teststreifensysteme zum schnellen Nachweis klinisch relevanter Parameter oder zur Qualitätssicherung von Lebensmitteln werden nicht nur in Entwicklungsländern immer wichtiger. Wir erarbeiten eine simple diagnostische Plattform, die sich besonders für nukleinsäure-basierte Formate eignet. Als Referenzassay werden pathogene Erreger in humanen Proben diagnostiziert.
Eine Vielzahl verschiedener Proteine zeigen spezifische DNA-bindende Eigenschaften, die mit gezielten zellulären Funktionalitäten verknüpft sind. Wir nutzen Zinkfinger-Proteine, die definierte Nukleinsäuresequenzen binden und als immobilisierte Elemente eines Proteinarrays doppelsträngige DNA aus Probelösungen fangen können.
Des Weiteren fokussieren wir uns auf funktionelle Proteine, die Nukleinsäuren pathogener Erreger aus einem Überschuss humaner DNA isolieren können. Diese Proteine sollen Einsatz in neuartigen Aufreinigungsverfahren finden.
Der moderne Luftverkehr dient nicht nur dem schnellen Transport von Personen oder Waren. Auch Infektionserreger legen als unerwünschte Passagiere in Flugzeugen weite Strecken innerhalb weniger Stunden zurück. So ist es möglich, dass sich Infektionserkrankungen wie Influenza oder SARS, die sich zu Pandemien entwickeln können, heutzutage schnell ausbreiten. Schritte zur effektiven Eindämmung von Infektionsketten im Bereich der Mobilität sind weltweit noch nicht effektiv etabliert. Erste Ansätze mittels einfacher Fragebögen oder berührungsloser Temperaturmessung sind allerdings weitestgehend wirkungslos geblieben. Das Projekt »HyFly«, gefördert vom Bundesministerium für Bildung und Forschung im Rahmen der InfectControl 2020-Initiative, setzt am sensiblen Punkt der Fluggastkontrolle an. Dabei soll ein nicht-invasives Verfahren auf Basis der Ionenmobilitätsspektrometrie (IMS) entwickelt werden. Infizierte Personen können damit in wenigen Minuten über Bestandteile ihrer Atemluft identifiziert werden. IMS wird bereits weltweit routinemäßig eingesetzt, um an Flughäfen Drogen- oder Sprengstoffreste nachzuweisen, sodass auf eine etablierte Infrastruktur zurückgegriffen werden kann. Detektiert werden sogenannte volatile organische Substanzen, die Stoffwechselprodukte von Mikroorganismen sind. Der Fokus liegt dabei auf bakteriellen Erregern, die laut Information des deutschen Robert-Koch-Instituts eine hohe Relevanz für den Luftverkehr besitzen. Erste Ergebnisse zeigen, dass die Methode ein großes Potenzial zur Diskriminierung zwischen verschiedenen Erregern besitzt. Neben der Systementwicklung wird eine Studie zur Identifikation von Mikroorganismen an verschiedenen internationalen Flughäfen erarbeitet, um die Reinigungseffizienz sowie den Einfluss antimikrobieller Beschichtungen zu ermitteln.
Parodontitis ist eine entzündliche Erkrankung des Zahnhalteapparats, die unbehandelt zum Zahnausfall führen kann. Allein in Deutschland wird prognostiziert, dass fast 12 Millionen Menschen von Parodontitis betroffen sind. Ursächlich wird die Parodontitis durch bakteriellen Plaque ausgelöst, der in einen Abbau des dentalen Knochengewebes münden kann. Intensiv untersucht wird ein systemischer Zusammenhang zwischen vorkommenden Parodontitis-Erregern und Herz-Kreislaufschädigungen, der schwerwiegende Erkrankungen wie Herz- oder Schlaganfälle auslösen könnte.
Ziel des Parodontitis-Chip-Projekts ist die Entwicklung einer vollintegrierten Diagnostikplattform sowohl für die schnelle Aufbereitung als auch der anschließenden Analyse von parodontal-pathogenen Erregern in komplexen Proben. Diese innovative Technologieplattform besteht aus einer kompakten mikrofluidischen Karte und einem kombinierten Aufreinigungsmodul, in denen die Arbeitsschritte der Isolation der Keime, gezielte Vervielfältigung der DNA-Sequenzen und deren Detektion ablaufen. Der Parodontitis-Chip soll Anwender*innen die Möglichkeit geben, elf relevante Bakterien, die bei der Entstehung der Parodontitis eine wesentliche Rolle spielen, in einem integrierten, sogenannten Lab-on-a-chip-Format parallel nachzuweisen und zu charakterisieren. Zusätzlich erfolgt die Etablierung eines einfachen Messsystems, das ein Monitoring der Reaktionskinetik ermöglichen wird. Damit soll eine Quantifizierung der Erreger sowie eine Bestimmung der Gesamtkeimzahl realisiert werden.
Mit dem Parodontitis-Chip entsteht eine einfache molekulardiagnostische Testplattform, die leicht auf verschiedene Fragestellungen im Bereich der medizinischen-, umwelt- oder Lebensmittelanalytik angepasst werden kann. Vereinfachte Lab-on-a-chip-Entwicklungen können durch einen extrem simplen Aufbau und der Integration berührungsfreier Detektionsverfahren zu einer deutlichen Zeit- und Kostenersparnis für Anwender*innen führen.
Beitrag zum Parodontitis-Chip im ARD Mittagmagazin, 12. März 2013
Tuberkulose ist eine Infektionskrankheit, welche durch Mycobacterium tuberculosis verusacht wird. Laut einem Bericht der WHO (World Health Organisation) aus dem Jahr 2013 ist Tuberkulose nach HIV die zweithäufigste Todesursache unter den Infektionskrankheiten.
Umso wichtiger ist es, frühzeitig eine zuverlässige Diagnose zu erstellen. Dazu entwickelt die Arbeitsgruppe gemeinsam mit der McMaster University in Hamilton (Kanada) ein Detektionssystem, welches den Anforderungen einer schnellen, einfachen und kostengünstigen Diagnose gerecht wird. Das Nukleinsäure-basierte Testsystem beinhaltet alle Schritte von der Isolierung des Erregers bis zur Nachweis der Hybridisierung der Ziel-Nukleinsäure an einer Erreger-spezifischen Sonde.
Seit Jahrzehnten versuchen Sportler*innen eine Verbesserung ihrer körperlichen Leistungsfähigkeit durch die Einnahme verbotener und vielfach gesundheitsschädlicher Substanzen zu erreichen. Die illegalen Produkte befördern Ausdauer sowie Muskelaufbau und verbessern die körperliche Regeneration nach intensiven Trainingseinheiten oder Wettbewerben. Die signifikanten Gesundheitsrisiken, wie Schädigung der Blutgefäße oder Krebsentwicklung, werden dabei billigend in Kauf genommen.
Im Rahmen unserer Forschung soll ein diagnostisches Verfahren entwickelt werden, das den Nachweis von Dopingmitteln im Blut oder Urin ermöglicht. Eine vollständige Integration der Probenvorbereitung und des analytischen Bioassays soll auf Basis eines Schnelltests bzw. mit Hilfe der Oberflächenplasmonresonanz (SPR)-Technologie realisiert werden.
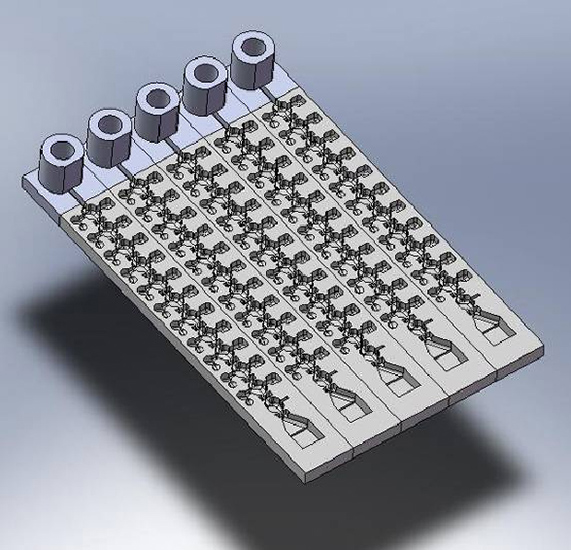

Komplexe und lebensbedrohliche Infektionserkrankungen (beispielsweise Sepsis) können derzeit nur mit aufwändigen, zeitraubenden Verfahren unter Einschaltung eines Analyselabors und mit qualifizierten Fachkräften zuverlässig diagnostiziert werden. Die Gruppe entwickelt in Kooperation mit europäischen Partnern ein innovatives System zur schnellen, einfachen und kostengünstigen Infektionsdiagnostik direkt vor Ort.
Das System basiert auf magnetischen Partikeln im Mikrometermaßstab, die je nach Anwendungsbereich als Träger für Antikörper und krankheitsassoziierte DNA-Sequenzen funktionalisierbar sind. Diese Magnetpartikel werden auf einem scheckkartenähnlichen Disposable eingesetzt. Bei der Vor-Ort-Untersuchung wird dem*der Patient*in eine Probe entnommen, etwa Blut, Speichel oder Urin, die dann in das Lab-on-chip-System integriert wird. Die Magnetpartikel binden nach Aufbruch der Zielzellen an die entsprechenden Zielmoleküle in der Probe und werden mit Magnetkraft vollautomatisch durch verschiedene Reaktionsgefäße transportiert. Am Ende der Prozesskette erfolgt die Diagnose mittels hochempfindlicher Magnetosensorik.
Das Projekt wird durch das Bundesministerium für Bildung und Forschung (BMBF) gefördert und durch die Magna Diagnostics GmbH, einer Ausgründung des Fraunhofer IZI, koordiniert.
Zirkulierende Tumorzellen (CTC) sind Krebszellen, die, abgesondert von einem Tumorgewebe, im peripheren Blut nachweisbar sind. Deren Isolierung und Charakterisierung hat in der onkologischen Forschung als auch in der Diagnostik eine zunehmende Bedeutung. So verwenden bereits zugelassene Systeme die Anzahl der CTC im Blut als prognostische Marker für die sogenannte personalisierte Medizin. Die Isolation dieser Zellen stellt jedoch höchste Anforderungen an die Diagnostik, da die Konzentrationen dieser seltenen Zellen im Blut von Patient*innen extrem niedrig ist. Im Unterschied zu Verfahren, die spezifische Oberflächenmarker von Krebszellen zur Isolation nutzen, verwenden wir die sogenannte ApoStream™ Technologie des amerikanischen Unternehmens ApoCell. Dieses Verfahren ermöglicht eine hochspezifische Isolation der CTC nur aufgrund ihres unterschiedlichen Verhaltens im dielektrophoretischen Feld. Um das System zu charakterisieren, entwickeln wir Surrogate – Ersatzstoffe für CTCs und PBMCs (Peripheral Blood Mononuclear Cells).
Reportergen-Assays sind in der modernen Forschung vielseitig verwendbar. Sie dienen vorrangig zur Charakterisierung regulatorischer Elemente (Promoter-Regionen) oder Modulatoren (Transkriptionsfaktoren) auf genomischer Ebene. Insbesondere Luciferase-basierte Reportergen-Assays sind heute in der biomedizinischen und pharmakologischen Forschung etabliert. Aufgrund der sehr niedrigen Nachweisgrenze konnten sie sich gegenüber fluoreszenzbasierten Reportergenen durchsetzen. Prinzipiell wird das zu untersuchende regulatorische, genetische Element vor ein Luciferase-Gen kloniert. Das Reportergenkonstrukt kann mittels herkömmlicher Transfektionsmethoden in ein ausgewähltes Zellsystem eingebracht werden. Die biologische Aktivität des klonierten genetischen Elements kann nun zeitabhängig charakterisiert werden. Das Fraunhofer IZI bietet ein komplettes Dual-Luciferase-System an, welches sich zur Untersuchung von genetischen, regulatorischen Elementen aus Säugetiergenomen eignet.
Die Methode beinhaltet drei Schritte:
optional:
Im Rahmen einer kooperativen Arbeit mit der Abteilung Allgemeine Biochemie der Universität Leipzig konnte die Aktivität des humanen GLO1-Promoters in verschiedenen Karzinom-Zelllinien untersucht werden. Derzeit wird der Einfluss von Hypoxie auf die Promoteraktivität untersucht.
Das System dient zur funktionellen Charakterisierung jedes erdenklichen regulatorischen Elements aus Säugergenomen. Zudem bietet das System die Möglichkeit zur Untersuchung von exogenen Faktoren in Kombination mit normalen oder veränderten Kulturbedingungen.
RNAi ist ein konservierter Mechanismus, welcher die Genexpression auf posttranskriptioneller Ebene reguliert. In Eukaryoten wird doppelsträngige RNA (dsRNA) zu kurzen, kleinen interferierenden RNAs (siRNA) prozessiert, welche die Degradierung der komplementären mRNA zur Folge hat. Dies führt letztendlich zur effektiven Herabregulierung des spezifischen Proteins. Diese charakteristischen Eigenschaften führen zur Anwendung RNAi in Zellkulturen sowie in Tiermodellen. Die spezifische Unterdrückung der Genexpression und Proteinaktivität modelliert die pharmakologische Inhibierung des Zielproteins und ist daher ein effektives Werkzeug für proof-of-principle-Experimente sowie die Identifizierung und Validierung von antitumoralen Wirkstoffen.
Im Rahmen des Referenzprojekts soll ein bereits identifiziertes Zielprotein für eine neuartige Krebstherapie mit der Bezeichnung Glyoxalase I (GLO I) spezifisch durch RNAi stufenweise herabreguliert werden. Zudem soll das System die Möglichkeit bieten, die GLO1 wieder heraufzuregulieren, um den Ausgangsphänotyp wieder herzustellen.
In Tumoren besteht ein starker Zusammenhang zwischen Signaltransduktionswegen und fundamentalen metabolischen Wegen, wie Glykolyse und Pentose-Phosphat-Zyklus. Viele tumorfördernde Mechanismen wirken direkt auf die Glykolyse, die zelluläre Antwort auf Sauerstoff und die Fähigkeit von Tumoren neue Gefäße zur eigenen Versorgung zu rekrutieren. Es ist seit Warburg bekannt, dass Tumore beständig anaerobe Wege zur Gewinnung von ATP durch Konvertierung von Glukose nutzen. Ein zytotoxisches Nebenprodukt der Glykolyse ist Methylglyoxal (MGO). Das reaktive MGO bindet in hohen Konzentrationen an Proteine und Nukleinsäuren, wodurch Apoptose induziert wird. Alle Organismen besitzen ein Glyoxalase-Enzymsystem (GLO I / GLO II) um eine Schädigung der Zellen durch hohe MGO-Konzentrationen zu verhindern. Insbesondere in Tumorzellen ist dieses System hochreguliert, um die hohen, parakatalystisch entstehenden MGO-Konzentrationen zu minimieren. Die Inhibierung der Glyoxalasen könnte daher eine wichtige Rolle in der Krebstherapie einnehmen. Bisher bezog sich die Charakterisierung der Glyoxalasen in malignen Tumoren nur auf histochemische Analysen, welche eine Überexpression in Tumoren zeigt. Durch das RNAi-Modell könnten spezifische GLO I-Inhibitoren in Substanzbibliotheken identifiziert werden.